Die Aufgaben des Instituts sind hauptsächlich im Bereich Lehre und Forschung angesiedelt und stellen innerhalb der Universitätsklinik ein Bindeglied zwischen experimentell-wissenschaftlicher Arbeit einerseits und Krankenversorgung in der Intensivmedizin andererseits dar. Dementsprechend wird bei allen experimentellen Untersuchungen besonderer Wert auf die klinischeRelevanz der verwendeten Modelle gelegt. So sollen chronische kardiovaskuläre, pulmonale sowie Stoffwechselerkrankungen berücksichtigt werden, die bei der Mehrzahl der Patienten vorhanden sind. Besonderes Augenmerk gilt der Integration von Überwachungs- und Therapiemaßnahmen, die zum Standard in der Intensivmedizin gehören, in das jeweilige experimentelle Design, um so eine möglichst weitgehende Übertragbarkeit der gewonnenen Ergebnisse für die tägliche Arbeit am Krankenbett zu ermöglichen.
Die Lehraktivität wird neben der studentischen Ausbildung in den Fächern Anästhesie, Notfallmedizin und Expeditionsmedizin vor allem durch den Lehrexport in die vorklinischen Fächer der Medizinischen Fakultät sowie durch die Fort- und Weiterbildung im Fach Tauchmedizin geprägt.
Experimentelle Methoden
Die Arbeitsgruppe befasst sich mit der Analyse der mitochondrialen Atmung in homogenisierten oder permeabilisierten Gewebeproben oder in Zellkulturen aus immortaliserten oder primären Zelllinien. Mittelpunkt der Analyse ist die Respirometrie (high-resolution respirometry), die eine genaue Erfassung des O2-Verbrauchs unter definierten Bedingungen erlaubt. Somit kann die mitochondriale Atmung bei verschiedenen, konstant gehaltenen Temperaturen (4°C – 40°C), pH-Werten und O2-Konzentrationen (>0,001 µM) erfasst werden. Die Analysen werden regelmäßig in Proben aus Muskelgewebe (Herzmuskel und Skelettmuskel), Leber, Niere und neuronales Gewebe durchgeführt. Ebenso werden regelmäßig verschiedene Zelltypen wie z.B. Zelllinien aus soliden Tumoren, hämatologische Zelllinien, frisch isolierte hämatologische Zellen (PBMC’s, Granulozyten), Cardiomyozyten, Hepatozyten, Zelllinien renalen Ursprungs sowie primäre Neurone untersucht. Begleitend zur Respirometrie wurde in den letzten Jahren die Fluoreszenzspektroskopie etabliert, mir der parallel zur Analyse der mitochondrialen Atmung zusätzlich das mitochondriale Membranpotential, die ATP-Produktion und die ROS-Generierung gemessen werden können.
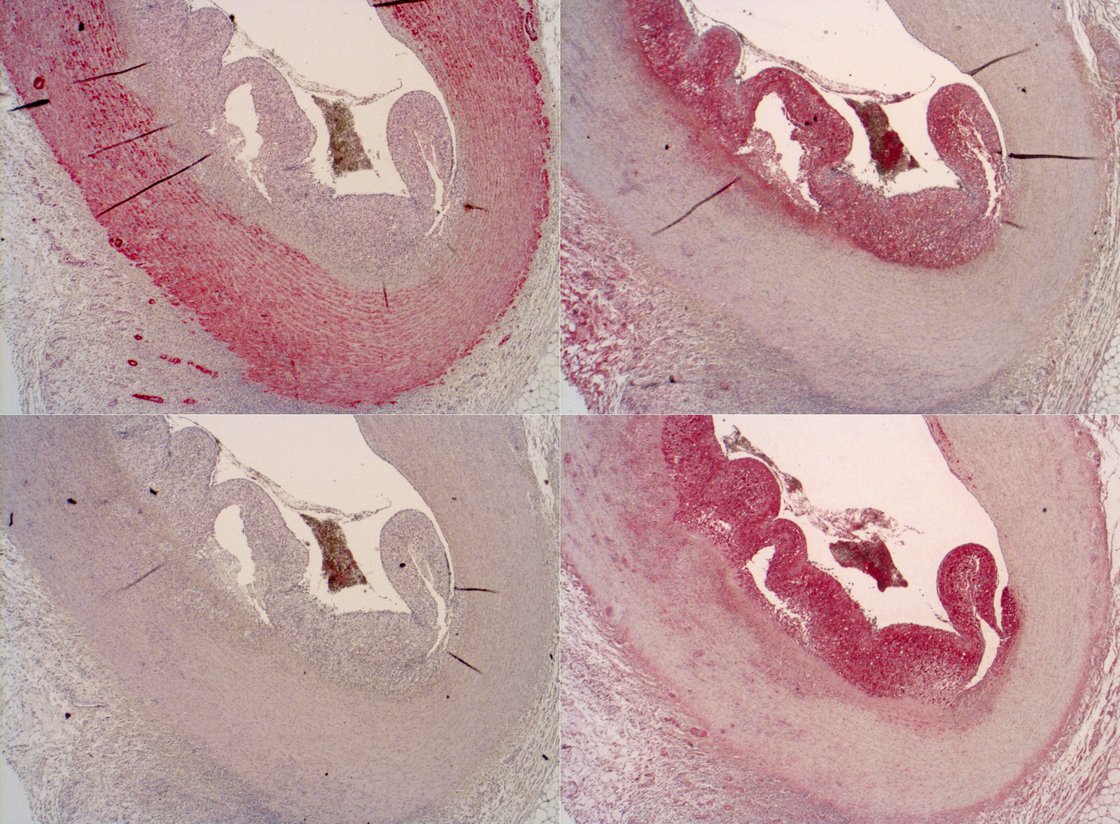
The histology and immunohistochemistry section of the Institute APV focuses on the processing and evaluation of biopsy and post mortem tissue samples, in collaboration with the Departments of Pathology and Neuroanatomy, for the determination of tissue injury in various organ systems: cardiovascular, renal, gastro-intestinal and central nervous system. In addition to classical routine stains like hematoxylin and eosin, periodic acid schiff and Nissl, using biotechnology based specific protein chemistry and biotinylated oligonucleotides we identify, in situ, biomarkers of interest for a variety of pathologies and their mechanisms: barrier dysfunction, apoptosis, inflammation and reactive oxygen and nitrogen species formation.
Diese Arbeitsgruppe arbeitet schwerpunktmäßig mit immortalisierten und primären Zellkulturen. Mittels vielfältiger Methoden (Immunfluoreszenz, Western Blot, Analyse der Mitochondrienfunktion, ROS-Generierung, und FACS Analyse) untersuchen wir die pathophysiologischen Mechanismen einer Sepsis und potentielle therapeutische Maßnahmen, welche in Zukunft bei einer schweren Sepsis im Klinikalltag Verwendung finden könnten. Hier spielt vor allem das H2S-System eine entscheidende Rolle, aber auch die gezielte Herunterregulation des Energiemetabolismus im Sinne einer “Suspended animation”.
Ein weiterer Schwerpunkt unseres Labors ist die Untersuchung des Energiemetabolismus von peripheren Immunzellen (PBMCs, Granulozyten), welche aus dem Blut isoliert werden. Das Ziel ist es zunächst Änderungen des Energiemetabolismus insbesondere während einer Sepsis oder schweren Hämorrhagie zu charakterisieren und möglicherweise als prognostischen Biomarker zu verwenden.
Quantitative Erfassung von Stoffwechselprozessen
Es kommen verschiedene spektroskopische / spektrometrische Messtechniken zum Einsatz:
Die Gas-Chromatographie/Massenspektrometrie (GC/MS) zur Bestimmung der Anreicherungsrate von Testsubstanzen, die mit stabilen Isotopen markiert wurden. Damit kann etwa die Glukoseproduktion und -Verwertung nicht invasiv charakterisiert werden oder die Aktivität einzelner Schritt des Krebs- oder Zitronensäure-Zyklus in einem Zellkultur-Ansatz bestimmt werden. Die GC/MS Technik erlaubt auch eine sensitive Bestimmung der Konzentrationen bestimmter Marker im Plasma, wie etwa Sulfid oder Creatinin.
NDIR-Spektroskopie: Mit dieser nicht-invasiven Technik kann in vivo die respiratorische Freisetzung von 13CO2 im Atemgas bestimmt werden. Bei oral verabreichten 13C-markierten Testsubstanzen kann damit die Absorption der Testsubstanz im Magen-Darm Bereich abgeschätzt werden. Mit diesem Ansatz wird in einer Kooperation mit der Sektion Operative Intensivmedizin der Klinik der Anästhesiologie die Funktionalität des Magen-Bereichs bei kritisch Kranken untersucht.
Elektronenspinresonanz (ESR) Spektroskopie: Radikale und oxidativer Stress spielen eine bedeutende Rolle bei vielen Krankheiten und biologischen Vorgängen. Für ein genaueres Verständnis ist eine präzise Messung nötig, welche wir mithilfe des ESR-Goldstandards etablieren, die hochspezifisch Radikale detektiert. Dabei interessieren wir uns besonders für oxidativen und nitrosativen Stress in biologischen Proben.
Kooperationspartner
Prof. Csaba Szabó, Department of Anesthesiology, University of Texas Medical Branch, Galveston, TX, USA
Prof. Christoph Thiemermann, Experimental Medicine & Nephrology, William Harvey Research Institute, London UK
Prof. Pierre Asfar; Dépt. de Réanimation Médicale, Centre Hospitalier Universitaire, Angers, Frankreich
Prof. Martin Matejovic; Fakultni nemocnice, Klinik anesteziologie a resuscitace, Pilzen, Tschechische Republik
Prof. Rui Wang; Department of Biology, Laurentian University, Sudbury, ON, Canada.
Prof. Jens. Anders; Institut für Theorie der Elektrotechnik, Universität Stuttgart.
Prof. Jan Tuckermann; Institut für Molekulare Endokrinologie der Tiere, Universität Ulm.
Prof. Boris Mizaikoff; Abt. Analytische und Bioanalytische Chemie, Universität Ulm.
Das Institut ist Mitglied in folgenden Forschungsverbünden:
Zentrum für Traumaforschung Ulm | ZTF |
DFG Sonderforschungsbereich 1149 | SFB1149 |
Graduierten Kolleg Pulmonsens | GRK 2203 |
Weiterhin kooperieren wir mit der Deutschen Traumastiftung. |