AG Dr. Lechel
Principal Investigator
Mitarbeiter
Forschungsgebiete
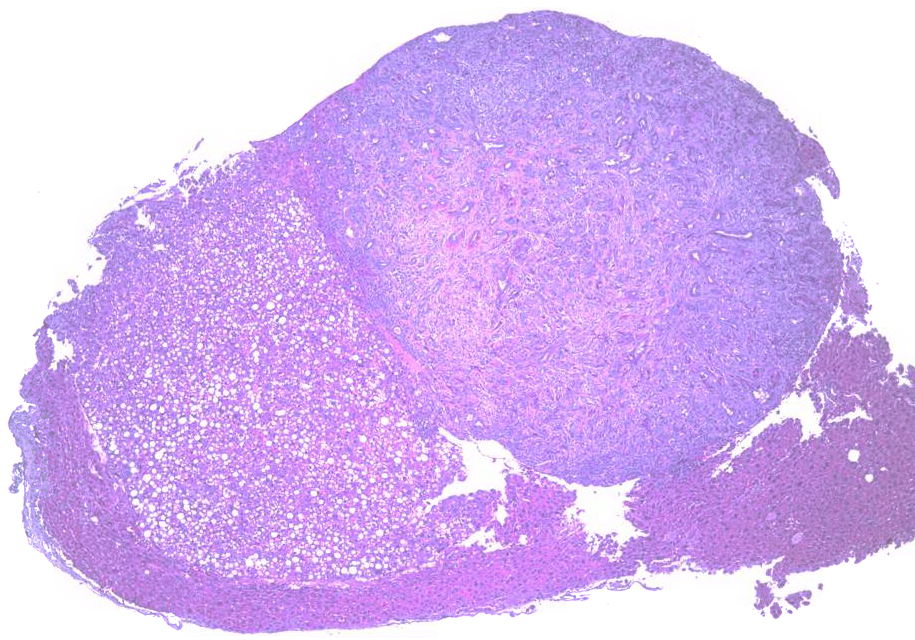
Das hepatozelluläre Karzinom (HCC) ist die sechsthäufigste Krebsart weltweit und nimmt mit 8,2% die am vierthäufigsten durch Krebs induzierte Todesursache ein. Die häufigsten Risikofaktoren für Leberkrebs sind chronische HBV/HCV Infektionen, Alkoholabusus und - in der westlichen Welt selten - Aflatoxin B1 Exposition. Die humane Hepatokarzinogenese ist analog zu anderen epithelialen Tumoren durch einen Verlust der p53-Kontrollpunktfunktion, Telomerverkürzung und chromosomale Instabilität charakterisiert. Der p53-Kontrollweg repräsentiert einen sehr relevanten Tumorsuppressor-Mechanismus, der bedeutend für das Schicksal einer geschädigten Zelle ist und festlegt, ob Zellreparatur, Apoptose oder Seneszenz erfolgt. Weiterhin beeinflusst p53 die zelluläre Differenzierung und die Stammzellfunktion. Es ist bekannt, dass p53-Mutationen in humanen Lebertumoren mit einer schlechten Prognose assoziiert sind. Interessanterweise weisen im Menschen 20-30% aller Lebertumore eine gemischte Differenzierung und Überlappungen in Genexpressionsprofilen mit Stamm- und Vorläuferzellen auf, was darauf hindeutet, dass der Ursprung dieser Tumore auf Stamm- oder Vorläuferzellen zurückzuführen sein dürfte.
Arbeiten im Mausmodell konnten zeigen, dass es bei einem leberspezifischen Verlust von p53 zur Entstehung von Lebertumoren kommt. Diese Lebertumore weisen zu rund 80% eine gemischte Differenzierung auf, d.h. im selben Tumorknoten findet man sowohl HCC (hepatozelluläres Karzinom)- als auch ICC (intrahepatisches Cholangiokarzinom)-Anteile.
Wir sind daran interessiert, die Entstehungsweise von gemischten Tumorentitäten in der Hepatokarzinogenese zu charakterisieren und die Sequenz des p53-Signalwegverlustes und weiterer "Driving Elements" in der Hepatokarzinogenese im Zusammenhang mit chronischen Leberschädigungen zu analysieren. Dieses Projekt wird innerhalb der GRK 2254 "Heterogeneity and Evolution in Solid Tumors (HEIST)" in Zusammenhang mit der Arbeitsgruppe on Prof. Reinhold Schirmbeck untersucht (Link). Des Weiteren liegen die Analyse von Genexpressionsdaten und die Entstehung von chromosomalen Aberrationen in unserem Interesse. Mit diesen Untersuchungen können wir unterschiedlich regulierte Signalwege in verschiedenen Tumorentitäten identifizieren.
Neben seiner Funktion bei der Entwicklung und Differenzierung von Gallengangszellen (Cholangiozyten) in der Leber, scheint der Notch-Signalweg auch eine wichtige Rolle bei der Leberkarzinogese zu spielen. Es konnte gezeigt werden, dass ein konstitutiv aktiver Notch-Signalweg im Mausmodell (Überexpression der intrazellulären Domäne des Notch-Rezeptors: NICD) zur Entstehung von hepatozellulären Karzinomen (HCC) mit cholangiozellulärer Differenzierung bzw. intrahepatischen Cholangiokarzinomen (ICC) führt. Dabei konnte gezeigt werden, dass diese Tumoren mit einer vermehrten Expression von Leberprogenitorzell-Markern einhergehen und ein geringeres Level an Markern für differenzierte Zellen (z.B. Albumin) aufweisen, was auf einen geringen Differenzierungsgrad dieser Tumore schließen lässt. Wird NICD in einem karzinogen (DEN)-induzierten Lebertumor-Mausmodell überexprimiert, so tritt eine beschleunigte Tumorentstehung mit einer Zunahme der Tumorgröße im Vergleich zu DEN-Lebertumoren ohne NICD-Überexpression auf. Der Effekt von Notch konnte auch in vitro in humanen HCC- als auch CC-Zelllinien gezeigt werden. Eine Inhibierung des Notch-Signalwegs geht mit einer verminderten Proliferation, Migration, Invasion und Kolonienanzahl im Soft-Agar-Assay sowie einer erhöhten Apoptoserate einher wohingegen eine Aktivierung des Notch-Signalwegs zu erhöhter Proliferation und Kolonienanzahl im Soft-Agar-Assay führt.
In Studien bei denen Genexpressionsprofile von humanen HCCs verglichen wurden, konnte zudem gezeigt werden, dass eine Notch-Expression mit einer schlechteren Prognose und einer schlechteren 5-Jahres-Überlebenschance korreliert. Jedoch sind hier kontroverse Daten zu finden, da ebenfalls gezeigt wurde, dass eine Notch-Signatur in humanen HCCs mit einem verlängerten Überleben der Patienten assoziiert ist. Ein möglicher Zusammenhang von Notch und p53, einem bei humanen Lebertumoren oft verändertes/mutiertes Tumorsuppressorgen in der Hepatokarzinogenese ist bisher nicht weitreichend untersucht worden. So konnte bisher nur gezeigt werden, dass eine Notch-Aktivierung einhergehend mit einer p53-Deletion bereits nach 6 Monaten in der murinen Leber zu intrahepatischen Cholangiokarzinomen führt. Eine weitere Studie mit einer alleinigen Aktivierung von Notch im selben Mausmodell führt nach einer längeren Latenzzeit von mehr als 9 Monaten zu einer konstanten Tumorentstehung in der Leber. In eigenen Versuchen konnten wir zeigen, dass eine alleinige Deletion von p53 erst nach 14-20 Monaten zur Lebertumorentstehung mit gemischter Differenzierung führt, was auf einen möglichen additiven Effekt von p53-Verlust und Notch-Aktivierung deuten könnte. Ebenso konnte gezeigt werden, dass eine Notch-Inhibierung mittels γ-Sekretase-Inhibitoren im Xenotransplant-Modell zu einem inhibierten Tumorwachstum mit gleichzeitiger Aktivierung von p53 kommt.
Unsere Arbeitsgruppe untersucht das Zusammenspiel von Notch und p53 in der Hepatokarzinogenese. Hierzu wird der Effekt von Aktivierung und Inaktivierung des Notch-Signalwegs in Lebertumoren mit Verlust von p53 in Hinblick auf Proliferation, Differenzierungsgrad und tumorigenes Potenzial untersucht.

Für die meisten Organe im adulten Organismus wurden bereits adulte Stammzellen beschrieben. So existieren neben den bereits sehr gut charakterisierten hämatopoetischen und intestinalen Stammzellen auch in der Leber adulte Stammzellen. Man weiß, dass adulte Stammzellen ebenso wie somatische Zellen altern. Die Stammzellalterung hängt hierbei von verschiedenen Faktoren ab. Es können (A) zellintrische Faktoren sein, die die Stammzelle altern lassen. Hierbei scheinen Telomere, die an den Enden der Chromosomen lokalisiert sind und eine Schutzfunktion für die Chromosomen darstellen, eine Rolle zu spielen. Verkürzen sich diese Telomersequenzen während der Alterung, so verliert die Zelle die Schutzfunktion der Telomere und es kann zur Schädigung der DNA in den Stammzellen kommen. Des Weiteren kann neben den zellinternen Vorgängen auch das Environment eine Rolle spielen. Hier kann es (B) das Mikroenvironment sein, welche die sogenannte Stammzellnische bildet und in Wechselwirkung mit den Stammzellen steht, als auch (C) das Makroenvironment, welches durch im Körper zirkulierende Faktoren auf die Stammzelle einwirken kann.
Unsere Gruppe ist daran interessiert, die Alterung von adulten Leberstammzellen zu untersuchen. Die hohe Regenerationseigenschaft der Leber wurde bereits in der griechischen Mythologie in der Sage von Prometheus beschrieben. Man weiß, dass in der Leber vor allem die Hepatozyten, welche mit rund 80% den Hauptanteil der Leber darstellen, an der Leberregeneration beteiligt sind. Kommt es zu einer Schädigung der Leber, so werden geschädigte Hepatozyten durch die Teilung von ausdifferenzierten Hepatozyten ersetzt. Es ist bekannt, dass somatische Zellen, so auch die Hepatozyten, eine proliferative Kapazität besitzen und sich nicht unbegrenzt häufig teilen können. Dies hat zur Folge, dass eine chronische Schädigung der Leber nicht unendlich durch die Teilung von Hepatozyten kompensiert werden kann. Hier kommt es zur Aktivierung von Leberstammzellen, welche bislang nur unzureichend beschrieben worden ist und noch viele Fragen offen lässt.
Wir konnten in unserer Gruppe zeigen, dass ein Verlust des Tumorsupressorgens p53 zu einer verlängerten Bipotenz von Leberprogenitorzellen führt. Die Bipotenz ist hierbei die Fähigkeit von Leberprogenitorzellen sich in zwei unterschiedliche Lineages zu differenzieren: Hepatozyten und Cholangiozyten (Gallengangszellen).
In Folge von chronischen Lebererkrankungen kommt es zu einer permanenten Schädigung des Lebergewebes. Die Leber ist in der Lage, sich selber zu regenerieren, so können z.B. geschädigte Hepatozyten durch die Teilung von ausdifferenzierten Hepatozyten erneuert werden und die Leber regenerieren. Die Lebergeneration läuft dabei in 3 Phasen ab: (A) Initiationsphase, (B) Progressionsphase und (C) Terminationsphase. In den einzelnen Phasen sind eine Reihe von Faktoren beteiligt. Fehlt ein entscheidender Faktor, so kommt es zur Störung oder sogar zu einer gravierenden Beeinträchtigung der Leberregeneration. Man konnte experimentell zeigen, dass die Verkürzung von Telomeren zu einer eingeschränkten Leberregeneration führt. Dies wurde in einem Alterungsmodell der Telomerverkürzung (Maus) gezeigt, in dem es bei einer stark verkürzten Telomersequenz zu einer verminderten Regenerationsfähigkeit kam. Bei solch derartig kurzen Telomeren kommt es zur Aktivierung des Seneszenz-Kontrollpunktes. Es werden hierbei Proteine wie p53 und p21 aktiviert, die zu einem Zellzyklusarrest führen. Ferner konnte im Menschen gezeigt werden, dass eine chronische Leberschädigung mit einer verkürzten Telomersequenz assoziiert ist und sehr häufig in der Leberzirrhose nachgewiesen werden kann. Eine Leberzirrhose entwickelt sich häufig in Folge einer chronischen Leberschädigung und kann nach langer Latenzzeit zu einem Lebertumor führen.
Wir sind daran interessiert, Faktoren zu analysieren, die den Seneszenzkontrollpunkt besser charakterisieren. Wir versuchen hier mit transgenen Modellsystemen spezifisch den Seneszenzkontrollpunkt zu modulieren und in Hinblick auf die Leberregeneration und die Entstehung von Lebertumoren zu analysieren.
The focus of this Special Issue is on the role of communication in gastrointestinal cancers, involving cell to cell communication, like communication between the microenvironment or the immune system and the tumor cell, as well as communication on the molecular level, like Wnt, NF-kB, mTOR playing a major role in signal transduction.
Gastrointestinal cancer, like colorectal cancer, pancreatic cancer and hepatocellular cancer belong to the most common causes of cancer mortality and therfor present a major health problem. Gastrointestinal cancers are characterized by their huge heterogeneity even if many mutations are present in several tumor entities.
A detailed molecular tumor analysis on biological interfaces is increasingly fundamental in choosing the most appropriate anti-cancer therapy for patients, open new doors for the development of precision medicine. Interdisciplinary teamwork with colleagues in pathology, bioinformatics, immunology, molecular biology, and other disciplines will help oncologists, integrating data and expertise from the work of professionals involved in prevention, early-diagnosis, basic and translational cancer research.
In this Special Issue, we invite your contributions, either in the form of original research articles, reviews, or shorter perspective articles on all aspects related to the theme of “Biological Interfaces in Gastrointestinal Cancer”. Relevant topics include, but are not limited to:
Keywords
- Liver cancer
- Pancreatic cancer
- Intestinal cancer
- Gastric cancer
- Tissue inflammation
- Microenvironment
- Innate and adaptive immune responses
- Checkpoint inhibitors
- Immunotherapy
- Precision medicine
- Model systems (e.g. transgenic mouse models, organoid culture)
Submission Deadline: 30. June 2020
Publikationen
Originalarbeiten
Scheffold A, Baig AH, Chen Z, von Löhneysen SE, Becker F, Morita Y, Avila AI, Groth M, Lechel A, Schmid F, Kraus JM, Kestler HA, Stilgenbauer S, Philipp M, Burkhalter MD. Elevated Hedgehog activity contributes to attenuated DNA damage responses in aged hematopoietic cells. Leukemia. 2019 Nov 14. doi: 10.1038/s41375-019-0641-3. [Epub ahead of print].
Njeru SN, Kraus J, Meena JK, Lechel A, Katz SF, Kumar M, Knippschild U, Azoitei A, Wezel F, Bolenz C, Leithäuser F, Gollowitzer A, Omrani O, Hoischen C, Koeberle A, Kestler HA, Günes C, Rudolph KL. Aneuploidy-inducing gene knockdowns overlap with cancer mutations and identify Orp3 as a B-cell lymphoma suppressor. Oncogene. 2020 Feb;39(7):1445-1465.
Svinarenko M, Katz SF, Tharehalli U, Mulaw MA, Maier HJ, Sunami Y, Fischer SK, Chen Y, Heurich S, Erkert L, Tannapfel A, Wirth T, Schirmbeck R, Seufferlein T, Lechel A. An IKK/NF-κB Activation/p53 Deletion Sequence Drives Liver Carcinogenesis and Tumor Differentiation. Cancers (Basel). 2019 Sep 21;11(10). pii: E1410.
Tharehalli U, Svinarenko M, Kraus JM, Kühlwein SD, Szekely R, Kiesle U, Scheffold A, Barth TFE, Kleger A, Schirmbeck R, Kestler HA, Seufferlein T, Oswald F, Katz SF, Lechel A. YAP Activation Drives Liver Regeneration after Cholestatic Damage Induced by Rbpj Deletion. Int J Mol Sci. 2018 Nov 29;19(12). pii: E3801.
Armacki M, Trugenberger AK, Ellwanger AK, Eiseler T, Schwerdt C, Bettac L, Langgartner D, Azoitei N, Halbgebauer R, Groß R, Barth T, Lechel A, Walter BM, Kraus JM, Wiegreffe C, Grimm J, Scheffold A, Schneider MR, Peuker K, Zeißig S, Britsch S, Rose-John S, Vettorazzi S, Wolf E, Tannapfel A, Steinestel K, Reber SO, Walther P, Kestler HA, Radermacher P, Barth TF, Huber-Lang M, Kleger A, Seufferlein T. Thirty-eight-negative kinase 1 mediates trauma-induced intestinal injury and multi-organ failure. J Clin Invest. 2018 Nov 1;128(11):5056-5072.
Jäger D, Lechel A, Tharehalli U, Seeling C, Möller P, Barth TFE, Mellert K. U-CH17P, -M and -S, a new cell culture system for tumor diversity and progression in chordoma. Int J Cancer. 2018 Apr 1;142(7):1369-1378.
Perkhofer L, Schmitt A, Romero Carrasco MC, Ihle M, Hampp S, Ruess DA, Hessmann E, Russell R, Lechel A, Azoitei N, Lin Q, Liebau S, Hohwieler M, Bohnenberger H, Lesina M, Algül H, Gieldon L, Schröck E, Gaedcke J, Wagner M, Wiesmüller L, Sipos B, Seufferlein T, Reinhardt HC, Frappart PO, Kleger A. ATM Deficiency Generating Genomic Instability Sensitizes Pancreatic Ductal Adenocarcinoma Cells to Therapy-Induced DNA Damage. Cancer Res. 2017 Oct 15;77(20):5576-5590.
Jäger D, Barth TFE, Brüderlein S, Scheuerle A, Rinner B, von Witzleben A, Lechel A, Meyer P, Mayer-Steinacker R, Baer AV, Schultheiss M, Wirtz CR, Möller P, Mellert K. HOXA7, HOXA9, and HOXA10 are differentially expressed in clival and sacral chordomas. Sci Rep. 2017 May 17;7(1):2032.
Schwörer S, Becker F, Feller C, Baig AH, Köber U, Henze H, Kraus JM, Xin B, Lechel A, Lipka DB, Varghese CS, Schmidt M, Rohs R, Aebersold R, Medina KL, Kestler HA, Neri F, von Maltzahn J, Tümpel S, Rudolph KL. Epigenetic stress responses induce muscle stem-cell ageing by Hoxa9 developmental signals. Nature. 2016 Dec 15;540(7633):428-432.
Hohwieler M, Illing A, Hermann PC, Mayer T, Stockmann M, Perkhofer L, Eiseler T, Antony JS, Müller M, Renz S, Kuo CC, Lin Q, Sendler M, Breunig M, Kleiderman SM, Lechel A, Zenker M, Leichsenring M, Rosendahl J, Zenke M, Sainz B Jr, Mayerle J, Costa IG, Seufferlein T, Kormann M, Wagner M, Liebau S, Kleger A. Human pluripotent stem cell-derived acinar/ductal organoids generate human pancreas upon orthotopic transplantation and allow disease modelling. Gut. 2017 Mar;66(3):473-486. doi: 10.1136/gutjnl-2016-312423.
Scheffold A, Holtman IR, Dieni S, Brouwer N, Katz SF, Jebaraj BM, Kahle PJ, Hengerer B, Lechel A, Stilgenbauer S, Boddeke EW, Eggen BJ, Rudolph KL, Biber K. Telomere shortening leads to an acceleration of synucleinopathy and impaired microglia response in a genetic mouse model. Acta Neuropathol Commun. 2016 Aug 22;4(1):87.
Hohwieler M, Renz S, Liebau S, Lin Q, Lechel A, Klaus J, Perkhofer L, Zenke M, Seufferlein T, Illing A, Müller M, Kleger A. "Miniguts" from plucked human hair meet Crohn's disease. Z Gastroenterol. 2016 Aug;54(8):748-59.
Russell R, Ilg M, Lin Q, Wu G, Lechel A, Bergmann W, Eiseler T, Linta L, Kumar P P, Klingenstein M, Adachi K, Hohwieler M, Sakk O, Raab S, Moon A, Zenke M, Seufferlein T, Schöler HR, Illing A, Liebau S, Kleger A. A Dynamic Role of TBX3 in the Pluripotency Circuitry. Stem Cell Reports. 2015 Dec 8;5(6):1155-1170.
Russell R, Perkhofer L, Liebau S, Lin Q, Lechel A, Feld FM, Hessmann E, Gaedcke J, Güthle M, Zenke M, Hartmann D, von Figura G, Weissinger SE, Rudolph KL, Möller P, Lennerz JK, Seufferlein T, Wagner M, Kleger A. Loss of ATM accelerates pancreatic cancer formation and epithelial-mesenchymal transition. Nat Commun. 2015 Jul 29;6:7677.
von Witzleben A, Goerttler LT, Marienfeld R, Barth H, Lechel A, Mellert K, Böhm M, Kornmann M, Mayer-Steinacker R, von Baer A, Schultheiss M, Flanagan AM, Möller P, Brüderlein S, Barth TF. Preclinical Characterization of Novel Chordoma Cell Systems and Their Targeting by Pharmocological Inhibitors of the CDK4/6 Cell-Cycle Pathway. Cancer Res. 2015 Sep 15;75(18):3823-31.
Tao S, Tang D, Morita Y, Sperka T, Omrani O, Lechel A, Sakk V, Kraus J, Kestler HA, Kühl M, Rudolph KL. Wnt activity and basal niche position sensitize intestinal stem and progenitor cells to DNA damage. EMBO J. 2015 Mar 4;34(5):624-40. Erratum in: EMBO J. 2017 Oct 2;36(19):2920-2921.
Gonzalez OG, Assfalg R, Koch S, Schelling A, Meena JK, Kraus J, Lechel A, Katz SF, Benes V, Scharffetter-Kochanek K, Kestler HA, Günes C, Iben S. Telomerase stimulates ribosomal DNA transcription under hyperproliferative conditions. Nat Commun. 2014 Aug 13;5:4599.
Tschaharganeh DF, Xue W, Calvisi DF, Evert M, Michurina TV, Dow LE, Banito A, Katz SF, Kastenhuber ER, Weissmueller S, Huang CH, Lechel A, Andersen JB, Capper D, Zender L, Longerich T, Enikolopov G, Lowe SW. p53-Dependent Nestin Regulation Links Tumor Suppression to Cellular Plasticity in Liver Cancer. Cell. 2014 Jul 31;158(3):579-92.
Oeckl P, Scheffold A, Lechel A, Rudolph KL, Ferger B. Substantial telomere shortening in the substantia nigra of telomerase-deficient mice does not increase susceptibility to MPTP-induced dopamine depletion. Neuroreport. 2014 Mar 26;25(5):335-9.
Marhenke S, Buitrago-Molina LE, Endig J, Orlik J, Schweitzer N, Klett S, Longerich T, Geffers R, Sánchez Muñoz A, Dorrell C, Katz SF, Lechel A, Weng H, Krech T, Lehmann U, Dooley S, Rudolph KL, Manns MP, Vogel A. p21 promotes sustained liver regeneration and hepatocarcinogenesis in chronic cholestatic liver injury. Gut. 2014 Sep;63(9):1501-12.
Biniossek ML, Lechel A, Rudolph KL, Martens UM, Zimmermann S. Quantitative proteomic profiling of tumor cell response to telomere dysfunction using isotope-coded protein labeling (ICPL) reveals interaction network of candidate senescence markers. J Proteomics. 2013 Oct 8;91:515-35.
Linta L, Stockmann M, Lin Q, Lechel A, Proepper C, Boeckers TM, Kleger A, Liebau S. Microarray-Based Comparisons of Ion Channel Expression Patterns: Human Keratinocytes to Reprogrammed hiPSCs to Differentiated Neuronal and Cardiac Progeny. Stem Cells Int. 2013;2013:784629.
Schwitalla S, Ziegler PK, Horst D, Becker V, Kerle I, Begus-Nahrmann Y, Lechel A, Rudolph KL, Langer R, Slotta-Huspenina J, Bader FG, Prazeres da Costa O, Neurath MF, Meining A, Kirchner T, Greten FR. Loss of p53 in enterocytes generates an inflammatory microenvironment enabling invasion and lymph node metastasis of carcinogen-induced colorectal tumors. Cancer Cell. 2013 Jan 14;23(1):93-106.
Jebaraj BM, Kienle D, Lechel A, Mertens D, Heuberger M, Ott G, Rosenwald A, Barth TF, Möller P, Zenz T, Döhner H, Stilgenbauer S. Telomere length in mantle cell lymphoma. Blood. 2013 Feb 14;121(7):1184-7.
Begus-Nahrmann Y, Hartmann D, Kraus J, Eshraghi P, Scheffold A, Grieb M, Rasche V, Schirmacher P, Lee HW, Kestler HA, Lechel A, Rudolph KL. Transient telomere dysfunction induces chromosomal instability and promotes carcinogenesis. J Clin Invest. 2012 Jun 1;122(6):2283-8.
Wang J, Sun Q, Morita Y, Jiang H, Gross A, Lechel A, Hildner K, Guachalla LM, Gompf A, Hartmann D, Schambach A, Wuestefeld T, Dauch D, Schrezenmeier H, Hofmann WK, Nakauchi H, Ju Z, Kestler HA, Zender L, Rudolph KL. A differentiation checkpoint limits hematopoietic stem cell self-renewal in response to DNA damage. Cell. 2012 Mar 2;148(5):1001-14.
Katz SF, Lechel A, Obenauf AC, Begus-Nahrmann Y, Kraus JM, Hoffmann EM, Duda J, Eshraghi P, Hartmann D, Liss B, Schirmacher P, Kestler HA, Speicher MR, Rudolph KL. Disruption of Trp53 in livers of mice induces formation of carcinomas with bilineal differentiation. Gastroenterology. 2012 May;142(5):1229-1239.e3.
Kleger A, Mahaddalkar PU, Katz SF, Lechel A, Joo JY, Loya K, Lin Q, Hartmann D, Liebau S, Kraus JM, Cantz T, Kestler HA, Zaehres H, Schöler H, Rudolph KL. Increased reprogramming capacity of mouse liver progenitor cells, compared with differentiated liver cells, requires the BAF complex. Gastroenterology. 2012 Apr;142(4):907-17.
Müller M, Stockmann M, Malan D, Wolheim A, Tischendorf M, Linta L, Katz SF, Lin Q, Latz S, Brunner C, Wobus AM, Zenke M, Wartenberg M, Boeckers TM, von Wichert G, Fleischmann BK, Liebau S, Kleger A. Ca2+ activated K channels-new tools to induce cardiac commitment from pluripotent stem cells in mice and men. Stem Cell Rev. 2012 Sep;8(3):720-40.
Sperka T, Song Z, Morita Y, Nalapareddy K, Guachalla LM, Lechel A, Begus-Nahrmann Y, Burkhalter MD, Mach M, Schlaudraff F, Liss B, Ju Z, Speicher MR, Rudolph KL. Puma and p21 represent cooperating checkpoints limiting self-renewal and chromosomal instability of somatic stem cells in response to telomere dysfunction. Nat Cell Biol. 2011 Dec 4;14(1):73-9.
Watabe-Rudolph M, Begus-Nahrmann Y, Lechel A, Rolyan H, Scheithauer MO, Rettinger G, Thal DR, Rudolph KL. Telomere shortening impairs regeneration of the olfactory epithelium in response to injury but not under homeostatic conditions. PLoS One. 2011;6(11):e27801
Hartmann D, Srivastava U, Thaler M, Kleinhans KN, N'kontchou G, Scheffold A, Bauer K, Kratzer RF, Kloos N, Katz SF, Song Z, Begus-Nahrmann Y, Kleger A, von Figura G, Strnad P, Lechel A, Günes C, Potthoff A, Deterding K, Wedemeyer H, Ju Z, Song G, Xiao F, Gillen S, Schrezenmeier H, Mertens T, Ziol M, Friess H, Jarek M, Manns MP, Beaugrand M, Rudolph KL. Telomerase gene mutations are associated with cirrhosis formation. Hepatology. 2011 May;53(5):1608-17.
Sirma H, Kumar M, Meena JK, Witt B, Weise JM, Lechel A, Ande S, Sakk V, Guguen-Guillouzo C, Zender L, Rudolph KL, Günes C. The promoter of human telomerase reverse transcriptase is activated during liver regeneration and hepatocyte proliferation. Gastroenterology. 2011 Jul;141(1):326-37, 337.e1-3.
Nalapareddy K, Choudhury AR, Gompf A, Ju Z, Ravipati S, Leucht T, Lechel A, Rudolph KL. CHK2-independent induction of telomere dysfunction checkpoints in stem and progenitor cells. EMBO Rep. 2010 Aug;11(8):619-25.
Kleger A, Seufferlein T, Malan D, Tischendorf M, Storch A, Wolheim A, Latz S, Protze S, Porzner M, Proepper C, Brunner C, Katz SF, Varma Pusapati G, Bullinger L, Franz WM, Koehntop R, Giehl K, Spyrantis A, Wittekindt O, Lin Q, Zenke M, Fleischmann BK, Wartenberg M, Wobus AM, Boeckers TM, Liebau S. Modulation of calcium-activated potassium channels induces cardiogenesis of pluripotent stem cells and enrichment of pacemaker-like cells. Circulation. 2010 Nov 2;122(18):1823-36.
Begus-Nahrmann Y, Lechel A, Obenauf AC, Nalapareddy K, Peit E, Hoffmann E, Schlaudraff F, Liss B, Schirmacher P, Kestler H, Danenberg E, Barker N, Clevers H, Speicher MR, Rudolph KL. p53 deletion impairs clearance of chromosomal-instable stem cells in aging telomere-dysfunctional mice. Nat Genet. 2009 Oct;41(10):1138-43.
Hartmann N, Reichwald K, Lechel A, Graf M, Kirschner J, Dorn A, Terzibasi E, Wellner J, Platzer M, Rudolph KL, Cellerino A, Englert C. Telomeres shorten while Tert expression increases during ageing of the short-lived fish Nothobranchiusfurzeri. Mech Ageing Dev. 2009 May;130(5):290-6.
Schaetzlein S, Kodandaramireddy NR, Ju Z, Lechel A, Stepczynska A, Lilli DR, Clark AB, Rudolph C, Kuhnel F, Wei K, Schlegelberger B, Schirmacher P, Kunkel TA, Greenberg RA, Edelmann W, Rudolph KL. Exonuclease-1 deletion impairs DNA damage signaling and prolongs lifespan of telomere-dysfunctional mice. Cell. 2007 Sep 7;130(5):863-77.
Lechel A, Holstege H, Begus Y, Schienke A, Kamino K, Lehmann U, Kubicka S, Schirmacher P, Jonkers J, Rudolph KL. Telomerase deletion limits progression of p53-mutant hepatocellular carcinoma with short telomeres in chronic liver disease. Gastroenterology. 2007 Apr;132(4):1465-75.
Plentz RR, Park YN, Lechel A, Kim H, Nellessen F, Langkopf BH, Wilkens L, Destro A, Fiamengo B, Manns MP, Roncalli M, Rudolph KL. Telomere shortening and inactivation of cell cycle checkpoints characterize human hepatocarcinogenesis. Hepatology. 2007 Apr;45(4):968-76.
Choudhury AR, Ju Z, Djojosubroto MW, Schienke A, Lechel A, Schaetzlein S, Jiang H, Stepczynska A, Wang C, Buer J, Lee HW, von Zglinicki T, Ganser A, Schirmacher P, Nakauchi H, Rudolph KL. Cdkn1a deletion improves stem cell function and lifespan of mice with dysfunctional telomeres without accelerating cancer formation. Nat Genet. 2007 Jan;39(1):99-105.
Lechel A, Satyanarayana A, Ju Z, Plentz RR, Schaetzlein S, Rudolph C, Wilkens L, Wiemann SU, Saretzki G, Malek NP, Manns MP, Buer J, Rudolph KL. The cellular level of telomere dysfunction determines induction of senescence or apoptosis in vivo. EMBO Rep. 2005 Mar;6(3):275-81.
Reviewartikel
Tharehalli U, Svinarenko M, Lechel A. Remodelling and Improvements in Organoid Technology to Study Liver Carcinogenesis in a Dish. Stem Cells Int. 2019 Feb 19;2019:3831213.
Kumar M, Lechel A, Güneş Ç. Telomerase: The Devil Inside. Genes (Basel). 2016 Jul 29;7(8). pii: E43. doi: 10.3390/genes7080043.
Lechel A, Rudolph KL. Rho GTPase and Wnt signaling pathways in hepatocarcinogenesis. Gastroenterology. 2008 Mar;134(3):875-8.
Lechel A, Manns MP, Rudolph KL. Telomeres and telomerase: new targets for the treatment of liver cirrhosis and hepatocellular carcinoma. J Hepatol. 2004 Sep;41(3):491-7.
Commentary
Berasain C, Lechel A. Targeting the correct target in HCC. Gut. 2017 Aug;66(8):1352-1354.
Lechel A, Gougelet A. Early HCC treatment: a future strategy against interferon/miR-484 axis to revert precancerous lesions? Gut. 2016 Jul;65(7):1073-4.
Buchartikel
El Serag H, Lechel A, Rudolph KL. Epidemiology and Molecular Mechanisms of Hepatocarcinogenesis. In: Zakim and Boyer´s Hepatology: A Textbook of Liver Disease, Editors: Thomas D. Boyer, Michael P. Manns, Arun J. Sanyal. 2011; 6th Edt: Chapter 10.
Tillmann HL, Plentz RR, Lechel A, Rudolph KL. Telomeres and telomerase in liver disease and cancer. In: The Liver: Biology and Pathobiology, Editors: Irwin Arias (Editor), Allan Wolkoff (Co-Editor), James Boyer (Co-Editor), David Shafritz (Co-Editor), Nelson Fausto (Co-Editor), Harvey Alter (Co-Editor), David Cohen (Co-Editor). 2009; 5th Edt.: Chapter 68.
Schirmacher P, Lechel A, Rudolph L. Molekulare Pathogenese des hepatozellulären Karzinoms. In: Greten TF, Manns MP. (Hrsg): Das hepatozelluläre Karzinom- Diagnostik und aktuelle Therapiekonzepte. 2008.
Stellenanzeigen
Masterarbeit im Bereich der Hepatokarzinogenese und Leberregeneration zu vergeben. Anfragen bitte per E-Mail an die folgende Adresse: andre.lechel@uni-ulm.de.




