Forschungsschwerpunkte
Veränderte Signalwege in B-Zell-Lymphomen
Die konstitutive Aktivierung unterschiedlicher Signalwege ist essentiell für die Pathobiologie von B-Zell-Lymphomen. Dabei kann diese Aktivierung sowohl durch externe Faktoren - wie z.B. durch Zytokine oder Wachstumsfaktoren, die durch Tumor-infiltrierende-Lymphozyten sezerniert werden- begründet sein, als auch durch intrinsische Faktoren - wie z.B. durch Hotspot-Mutationen in Onkogenen oder inaktivierende Mutationen in Tumor-Suppressorgenen. Im Focus unserer Forschung zu B-Zell-Lymphomen stehen zwei wesentliche Signalkaskaden: Die JAK/STAT (Janus-Kinase/Signal-Transducer-and-Activator-of-Transcription) Kaskade und die NF-κB Kaskade.
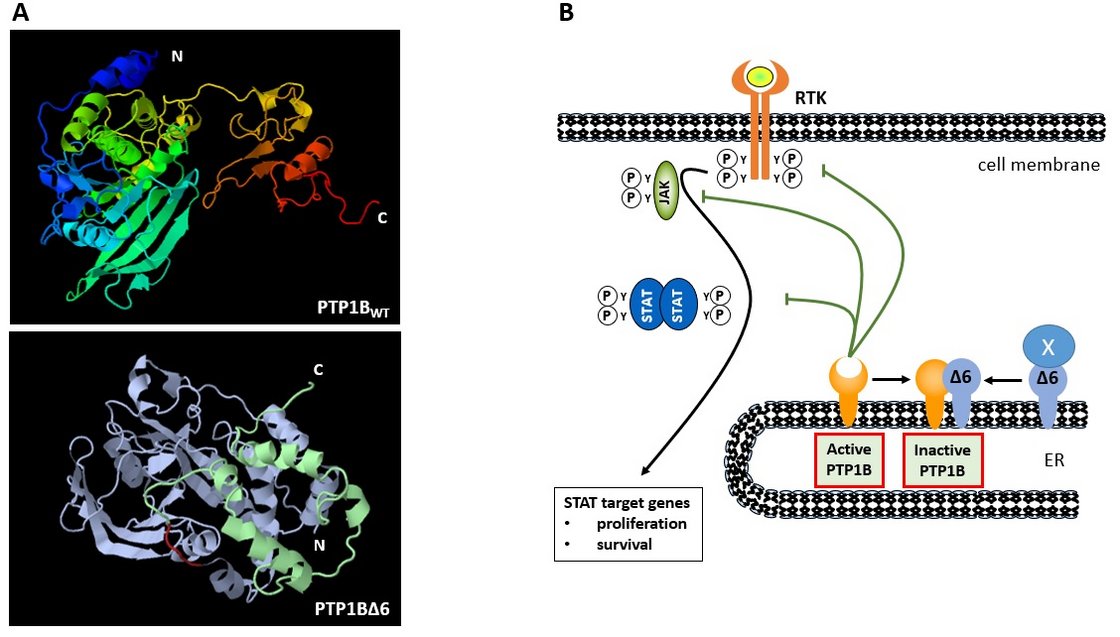
Wir interessieren uns bei der Analyse des JAK/STAT-Signalwegs für zwei negative Regulatoren dieser Kaskade - SOCS1 (Suppressor of Cytokine Signaling 1) und PTP1B (Protein Tyrosine Phosphatase 1B). Im Zentrum der Analysen stehen nicht nur die Bedeutung der intakten PTP1B- und SOCS1-Proteine, sondern vor allen Dingen auch die potentielle Rolle von mutierten Varianten dieser negativen JAK/STAT-Regulatoren, da beide Tumor-Suppressorgene in verschiedenen B-Zell-Lymphomarten häufig mutiert sind. Hier haben wir in der Vergangenheit bereits gezeigt, dass unterschiedliche Varianten von PTP1B, denen einzelne Exonbereiche fehlen, nicht nur einen Ausfall der negativen PTP1B-Wirkung verzeichnen, sondern darüber hinaus onkogene Wirkung entfalten. Dazu gehört neben einer verstärkenden Wirkung auf den JAK/STAT-Signalweg auch ein positiver Einfluss auf das Überleben und das Wachstum von Hodgkin-B-Zell-Lymphom-Zelllinien.
Die Analyse der NF-κB-Signalwege in B-Zell-Lymphomen ist der zweite Focus dieses Forschungsschwerpunktes. Hier konzentrieren wir uns ganz gezielt auf die Bedeutung und Regulation des Signal-induzierten Abbaus des NF-κB-Transkriptionsfaktors RelB. RelB kann sowohl als Teil des sogenannten alternativen NF-κB-Signalweges eine positive Funktion ausüben als auch als Teil eines epigenetischen Regulationsmechanismus die NF-κB-abhängige Genexpression negativ beeinflussen. So kommt RelB in ruhenden T- und B-Zellen die Rolle zu, eine Expression wichtiger T- und B-Zell-assoziierter Gene zu unterdrücken. Dieser negative RelB-vermittelte Genexpressionsblock wird jedoch im Zuge der Antigenrezeptor-Aktivierung in lymphoiden Zellen durch den geregelten Abbau von RelB beseitigt. Interessanterweise erfolgt dieser Abbau in manchen B-Zell-Lymphomen (z.B. den DLBCL des ABC-Typs) konstitutiv und stellt dabei einen wichtigen, für das Überleben und Wachstum der Lymphomzellen essentiellen Pathomechanismus dar. Die Bedeutung und die Regulation dieses Pathomechanismus steht somit im Zentrum unserer Forschung.
Projektteam:
Prof. Dr. Peter Möller
Prof. Dr. Ralf Marienfeld
Dr. Malena Zahn
Julia Wildfeuer
A new reliable and highly specific monoclonal antibody to detect the C-terminal region of Silencer of Cytokine Signaling 1 (SOCS1). Weissinger SE, Zahn M, Marienfeld R, Tessmer C, Moldenhauer G, Möller P. Eur J Haematol. 2021 Mar 13. doi: 10.1111/ejh.13620.
The PTP1B mutant PTP1BD2-4 is a positive regulator of the JAK/STAT signalling pathway in Hodgkin lymphoma. Zahn M, Kaluszniak B, Möller P, Marienfeld R.Carcinogenesis. 2020 Dec 31:bgaa144. doi: 10.1093/carcin/bgaa144.
GSK3β modulates NF-κB activation and RelB degradation through site-specific phosphorylation of BCL10. Ali Abd-Ellah, Cornelia Voogdt, Daniel Krappmann, Peter Möller, Ralf B Marienfeld. Sci Rep. 2018 Jan 22;8(1):1352. doi: 10.1038/s41598-018-19822-z.
A novel PTPN1 splice variant upregulates JAK/STAT activity in classical Hodgkin lymphoma cells. Zahn M, Marienfeld R, Melzner I, Heinrich J, Renner B, Wegener S, Mießner A, Barth TF, Dorsch K, Brüderlein S, Möller P.Blood. 2017 Mar 16;129(11):1480-1490. doi: 10.1182/blood-2016-06-720516.
Tumorheterogenität beim Lungenkrebs
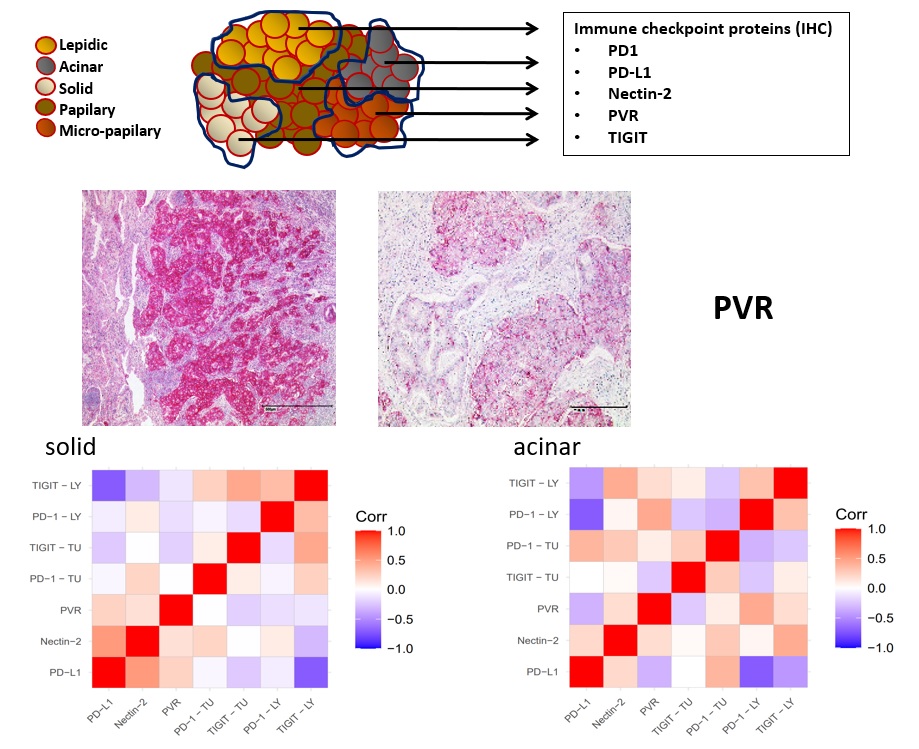
Der Lungenkrebs gehört nicht nur zu den häufigsten Krebsarten, sondern führt auch in besonders vielen Fällen zum Tode. Er wird in den kleinzelligen Lungenkrebs (small cell lung cancer, SCLC) und den nicht-kleinzelligen Lungenkrebs (non-small cell lung cancer, NSCLC) unterteilt, und dieser wiederum in Plattenepithelkarzinome, Adenokarzinome und großzellige Lungenkarzinome. Wegen seiner Aggressivität gehört diese Krebsart jedoch auch zu den am besten charakterisierten. Die Kenntnis einer ganzen Reihe von Treiber-Mutationen, die für das Überleben und Wachstum der Lungenkrebszellen essentiell sind, führte schon relativ früh zu der Entwicklung von Medikamenten, die als „small molecule inhibitors“ in die Tumorzellen gelangen und dort spezifisch mutierte Proteine hemmen und somit als Basis für die zielgerichtete Therapie (targeted therapy) dienen. Dazu gehören exemplarisch die EGFR-Inhibitoren sowie die ALK-Inhibitoren, die bei Vorliegen spezifischer EGFR-Mutationen oder ALK-Genumlagerungen zum Zuge kommen. Neben den zielgerichteten Therapien sind in jüngerer Zeit auch Immun-Checkpoint-Inhibitor (ICI)-Therapien erfolgreich bei der Behandlung eingesetzt worden. Die ICI sind Antikörper, die eine Rezeptor-Liganden-Bindung zwischen Tumor- und Immunzellen aufbrechen, welche die Basis für den „Immune-Escape“ des Tumors darstellen. So hemmt die Expression des Oberflächenmarkers PD-L1 durch Interaktion mit dem auf T-Zellen exprimierten Rezeptors PD-1 die Aktivität der T-Zellen und somit die Beseitigung der Tumorzellen. Jedoch wird der Erfolg sowohl der zielgerichteten Therapien als auch der ICI-Therapien durch die Tumorheterogenität beim Lungenkrebs gefährdet. So führen z.B. zusätzliche Mutationen zur Resistenzbildung bei den zielgerichteten Therapien und zu Therapieversagen. Die Analyse der Tumorheterogenität und seiner Auswirkungen auf den Therapieerfolg beim NSCLC stehen im Zentrum unseres Forschungsinteresses. Durch die Analyse von RNA- und DNA-Sequenzierungsdaten von therapieresistenten NSCLC-Fällen sollen neue und bessere Prädiktionswerkzeuge erarbeitet werden. Darüber hinaus untersuchen wir, wie die Expression der Immuncheckpoint-Proteine in den Tumorzellen reguliert wird. Dazu sind wir u.a. im nNGM-Konsortium sowie in der LuCaBio-Registerstudie engagiert.
Projektteam:
Prof. Dr. Ralf Marienfeld
Stefanie Mayer
Tobias Kolb
Adna Karic
Prof. Dr. Thomas Barth
Rescue of Non-Informative Circulating Tumor DNA to Monitor the Mutational Landscape in NSCLC. Stefanie Mayer, Gerlinde Schmidtke-Schrezenmeier, Christian Buske, Frank G Rücker, Thomas F E Barth, Peter Möller, Ralf Marienfeld. Cancers (Basel). 2020 Jul 16;12(7):1917. doi: 10.3390/cancers12071917.
Spatial distribution of immune checkpoint proteins in histological subtypes of lung adenocarcinoma. Sarah Müller, Stefanie Mayer, Peter Möller, Thomas F. E. Barth, and Ralf Marienfeld. Neoplasia. Accepted for publication.