Die wissenschaftliche Zielsetzung unserer Arbeitsgruppe besteht darin, besser zu verstehen, wie insbesondere Harnblasenkrebs beginnt, wächst und sich weiterentwickelt und wie wir die Behandlung optimieren können.
Harnblasenkrebs ist weltweit die sechsthäufigste Krebserkrankung bei Männern und die 17.-häufigste bei Frauen mit verschiedenen Typen und Histologien sowie einem sehr vielseitigen Krankheitsverlauf [1]. Während papilläre nicht-invasive Karzinome 5-Jahres-Überlebensraten von bis zu 95 % aufweisen, sterben mehr als 50 % der Patienten mit Metastasen innerhalb eines Jahres (5-Jahres-Überlebensrate 5 %) [2,3].
Unsere Forschungsaktivitäten basieren daher auf dem Verständnis der grundlegenden Organisation und Differenzierung des Epithels der Harnblase (Urothel) im normalen Zustand und bei gutartigen Veränderungen sowie bösartigen Tumorerkrankungen. Das anschließende zentrale Ziel unserer Arbeit ist die Entschlüsselung der molekularen Landschaften und klonalen Wachstumsmuster während der Entwicklung und des Fortschreitens von Urothel- und Plattenepithelkarzinomen der Harnblase. Dies wird die Subtypisierung von Tumoren verbessern und dazu beitragen, wirksame (gezielte und wahrscheinlich personalisierte) Therapieoptionen zu identifizieren und auszuwählen.
Forschungsschwerpunkte
Plattenepitheliale Differenzierung
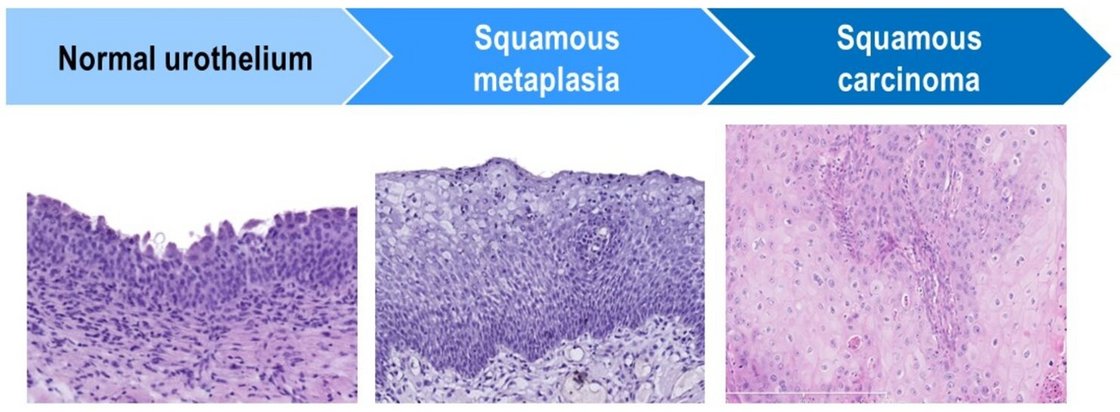
Das reine Plattenepithelkarzinom (SCC) der Harnblase ist eine selten diagnostizierte Erkrankung, die mit einer ungünstigen Prognose und weniger Möglichkeiten für eine vielversprechende (neo)adjuvante Therapie verbunden ist. Als mögliche, jedoch nicht immer vorhandene Vorläuferläsion werden verhornende Plattenepithelmetaplasien mit Dysplasie gehandelt [4]. Plattenepitheliale Umdifferenzierungen des Urothels treten jedoch auch in Folge von Entzündungsreizen auf und sind häufig stabile Läsionen ohne Entartungstendenz [4]. Die molekularen Mechanismen, die eine solch abnorme Differenzierung von Urothelzellen in Plattenepithelzellen ermöglichen und manchmal zu hochaggressiven Krebsarten führen, sind jedoch kaum verstanden. Daher interessieren wir uns für die Entwicklung von Plattenepithelkarzinomen der Harnblase mit besonderem Augenmerk auf mutmaßliche (frühe) Schlüsselfaktoren, die möglicherweise neue therapeutische Auswirkungen versprechen.
Klonale Evolution des Harnblasenkarzinoms
In der Tumorgenese der Harnblase existieren verschiedene Wege, welche sich auch morphologisch und prognostisch unterscheiden (siehe oben). Wir haben uns jedoch bereits in der Vergangenheit damit auseinandergesetzt, wie innerhalb eines Karzinoms Tumorheterogenität und klonales Wachstum auftreten und welche Bedeutung sie klinisch haben [5]. Interessant – und wenig erforscht - sind dabei auch die (epi)genetischen Landschaften urothelialer klonaler Expansionen vom Carcinoma in situ (CIS) zum muskelinvasiven Karzinom (MIBC). Wir interessieren uns für intra- und interpatienten-spezifische DNA-Methylierungsmuster (DNAme) und deren Auswirkungen auf transkriptionelle Netzwerke, die für die Progression einer CIS-(un-)abhängigen klonalen Expansion ursächlich sein können. Dieses Projekt ist Teil einer durch die Deutsche Forschungsgemeinschaft (DFG) geförderten Forschergruppe (https://gepris.dfg.de/gepris/projekt/493802833?context=projekt&task=showDetail&id=493802833&).
Therapeutische Ansätze beim Harnblasenkarzinom
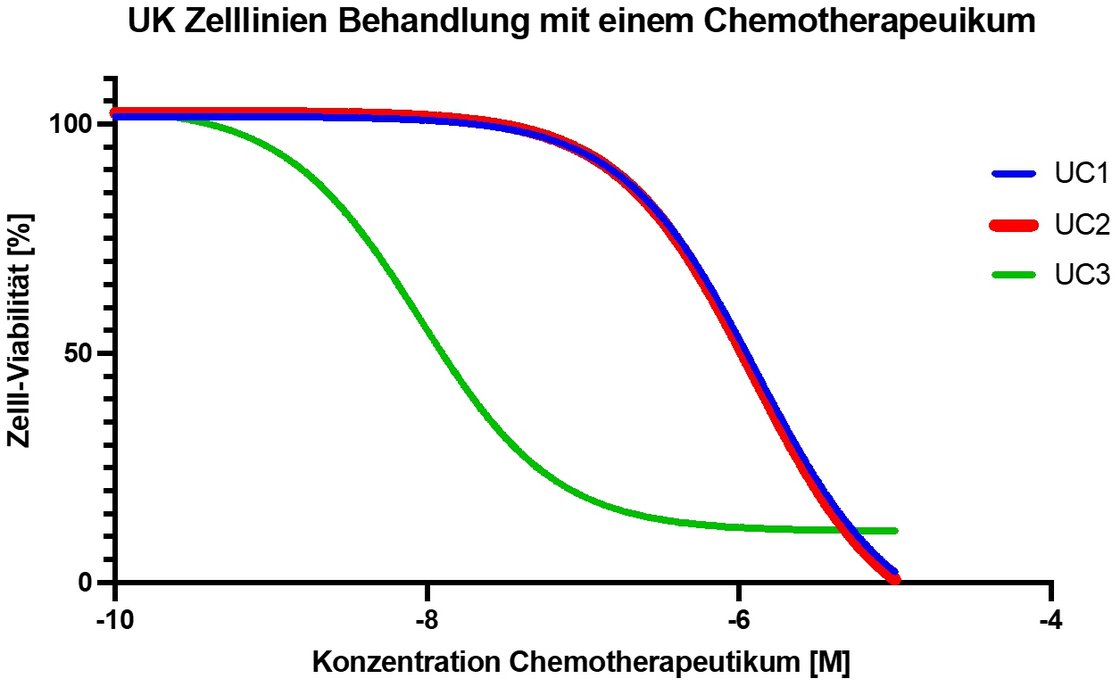
Im Zeitalter der personalisierten Medizin testen auch wir abhängig vom genetischen Hintergrund der Tumoren zielgerichtete, neuartige Therapeutika wie EGFR (Epidermal Growth Factor Receptor), FGFRs (Fibroblast Growth Factor Receptors), Immun-Checkpoint-Inhibitoren (PD-L1) oder S-methyl-5‘-thioadenosine phosphorylase (MTAP) in unserem Labor in der Zellkultur auf Effektivität. Therapieansprechen und Resistenzentwicklung sowie die zugrunde liegenden molekularen Mechanismen stehen hier im Fokus unserer Arbeit.
Unsere Arbeitsgruppe setzt eine breite Palette von Instrumenten ein, die auf Geweben, Zellkulturen, klassischer Molekularbiologie, Next Generation Sequencing (NGS) und Bioinformatik basieren, welche es uns ermöglichen, pathologische Veränderungen umfassend zu analysieren. Wir erweitern stetig unseren „Werkzeugkasten“ mit neuen In-vitro- und Ex-vivo-Methoden.
Wir sind offen für Kooperationsprojekte im Bereich Harnblasenkrebs (oder gastrointestinalen Tumorerkrankungen) und stehen in regem Austausch mit Forschenden innerhalb der Medizinischen Fakultät der Universität und des Uniklinikums Ulm, aber auch außerhalb von Ulm und Deutschland.
Team
Prof. Dr. med. Dr. nat. med. Nadine Gaisa
PD Dr. rer. nat. Michael Rose
Dr. rer. nat. Emil Chteinberg
Dr. rer. nat. Francesca Spada
Melika Rezaei, M. Sc.
Elisa Lemaitre, Ärztin
Stundierende:
Anastasiia Kyrychenko
Referenzen
[1] Jubber I, Ong S, Bukavina L, Black PC, Compérat E, Kamat AM, Kiemeney L, Lawrentschuk N, Lerner SP, Meeks JJ, Moch H, Necchi A, Panebianco V, Sridhar SS, Znaor A, Catto JWF, Cumberbatch MG. Epidemiology of Bladder Cancer in 2023: A Systematic Review of Risk Factors. Eur Urol. 2023 Aug;84(2):176-190. doi: 10.1016/j.eururo.2023.03.029
[2] Oliver-Krasinski JM, Bidot S, Ingram JW, O'Toole KM, McKiernan JM, Tinsley M, Harik LR. Noninvasive Papillary Urothelial Carcinoma of the Bladder: An Institutional Experience Focusing on Tumors With Borderline Features. Arch Pathol Lab Med. 2024 Feb 1;148(2):223-229. doi: 10.5858/arpa.2022-0268-OA.
[3] Soares A, Bourlon MT, Wong A, Joshi A, Jardim D, Korbenfeld E, Karak FE, Orlandi F, Sze H, Ansari J, Zarba J, Mansour MA, Manneh R, Thirumulai R, Tsai YC, Morsi WA, Powles T. Management of Metastatic Urothelial Carcinoma in Emerging Markets (EM): An Expert Opinion. Clin Genitourin Cancer. 2024 Apr;22(2):467-475. doi: 10.1016/j.clgc.2024.01.001
[4] Martin JW, Carballido EM, Ahmed A, Farhan B, Dutta R, Smith C, Youssef RF. Squamous cell carcinoma of the urinary bladder: Systematic review of clinical characteristics and therapeutic approaches. Arab J Urol. 2016 Aug 1;14(3):183-91. doi: 10.1016/j.aju.2016.07.001
[5] Heide T, Maurer A, Eipel M, Knoll K, Geelvink M, Veeck J, Knuechel R, van Essen J, Stoehr R, Hartmann A, Altmueller J, Graham TA, Gaisa NT. Multiregion human bladder cancer sequencing reveals tumour evolution, bladder cancer phenotypes and implications for targeted therapy. J Pathol. 2019 Jun;248(2):230-242. doi: 10.1002/path.5250.
Pannhausen J, Wirtz J, Mantwill K, Holm PS, Schwamborn K, Jonigk DD, Gschwend JE, Rose M, Gaisa NT, Nawroth R. Oncolytic virotherapy provides a potent therapy option for squamous bladder cancer. Sci Rep. 2025 Apr 18;15(1):13443. doi: 10.1038/s41598-025-96419-3. PMID: 40251219; PMCID: PMC12008219.
Melzer MK, Ma Y, Lindenmayer J, Morgenstern C, Wezel F, Zengerling F, Günes C, Gaisa NT, Kleger A, Bolenz C. Prospective pharmacotyping of urothelial carcinoma organoids for drug sensitivity prediction - feasibility and real world experience. Exp Hematol Oncol. 2024 Nov 12;13(1):112. doi: 10.1186/s40164-024-00579-3. PMID: 39533373; PMCID: PMC11558855.
Lammert FC, Pannhausen J, Noetzel E, Friedland F, Wirtz J, Herfs Y, Leypold S, Gan L, Weiskirchen R, Schnitzler T, Knüchel R, Maurer J, Jonigk DD, Rose M, Gaisa NT. Dual role of GRHL3 in bladder carcinogenesis depending on histological subtypes. Mol Oncol. 2024 Jun;18(6):1397-1416. doi: 10.1002/1878-0261.13623. Epub 2024 Mar 2. PMID: 38429970; PMCID: PMC11164254.