Urologisches Forschungslabor
Helmholtzstraße 10, D-89081 Ulm
Team


Dr. rer. nat. Anca Azoitei

Dr. rer. nat. Gregoire Najjar

Kuang Zheng

Hanyun Luo

Hengchuan Liu

Xiangyu Zhang

Zhiyu Wang

Michaela Eggel (MTA)

Iris Holzheu

Dr. med. Michael Melzer
Assistenzarzt, Junior Group Leader, Clinician Scientist
Schwerpunkte
Pluripotente Stammzellmodelle, Urothelkarzinomorganoide, Organkulturmodelle
Projekte/Research Topics
Molekulare Mechanismen der Initiation, Progression und Invasion des Harnblasenkarzinoms
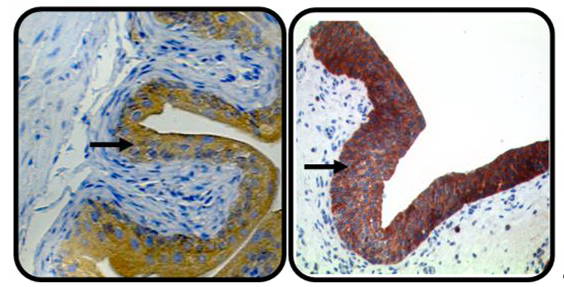
Das Urothelkarzinom ist eine der häufigsten Krebsdiagnosen weltweit und insbesondere Tumoren mit ausgeprägten chromosomalen Aberrationen, sogenannte ‚genomisch instabile‘ Karzinome, gehen mit einer schlechten Prognose einher. Bei der Entstehung spezifischer urothelialer Driver-Mutationen scheint die Kontrolle der Chromosomenstabilität eine wesentliche tumorbiologische und prognostische Bedeutung zu haben. In dieser Studie wird die Rolle von Ploidiekontrollgenen, welche in genomweiten shRNA-Screens aus eigenen Vorarbeiten der Arbeitsgruppe identifiziert wurden, in vitro und in vivo untersucht. Das Projekt soll den Einfluss von Ploidiekontrollgenen (z.B. ORP3, Abb. 1) auf die Karzinogenese des Urothelkarzinoms untersuchen und so die Entwicklung innovativer Therapieformen ermöglichen.
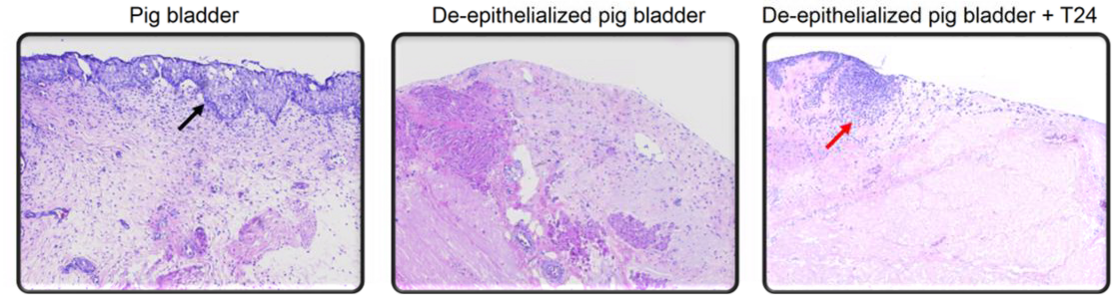
Die Metastasierung des Harnblasenkarzinoms ist der häufigste Grund für die hohe Mortalität dieser Erkrankung. Trotz radikaler Operation in einem klinisch begrenzten Tumorstadium (pT1 - pT3, pN0, R0) entwickeln bis zu 50% der Patienten im weiteren Verlauf Metastasen und versterben meist an der Erkrankung. Der frühen Tumorzellinvasion und Transmigration durch natürliche Barrieren und Zellschichten (u.a. die sog. Basalmembran) kommt dabei eine Schlüsselrolle zu. In unseren experimentellen Studien werden anhand von zellbiologischen Organkulturen (s. Abb. 2) und weiteren Methoden an der Identifikation molekularer Mechanismen der Tumorzellinvasion und Metastasierung gearbeitet. Die Erkenntnisse sollen entscheidend zur Entwicklung neuer therapeutischer Ansätze für die frühe Phase der Tumorzellausbreitung beim urothelialen Harnblasenkarzinom beitragen.
Telomerase und Telomerbiologie
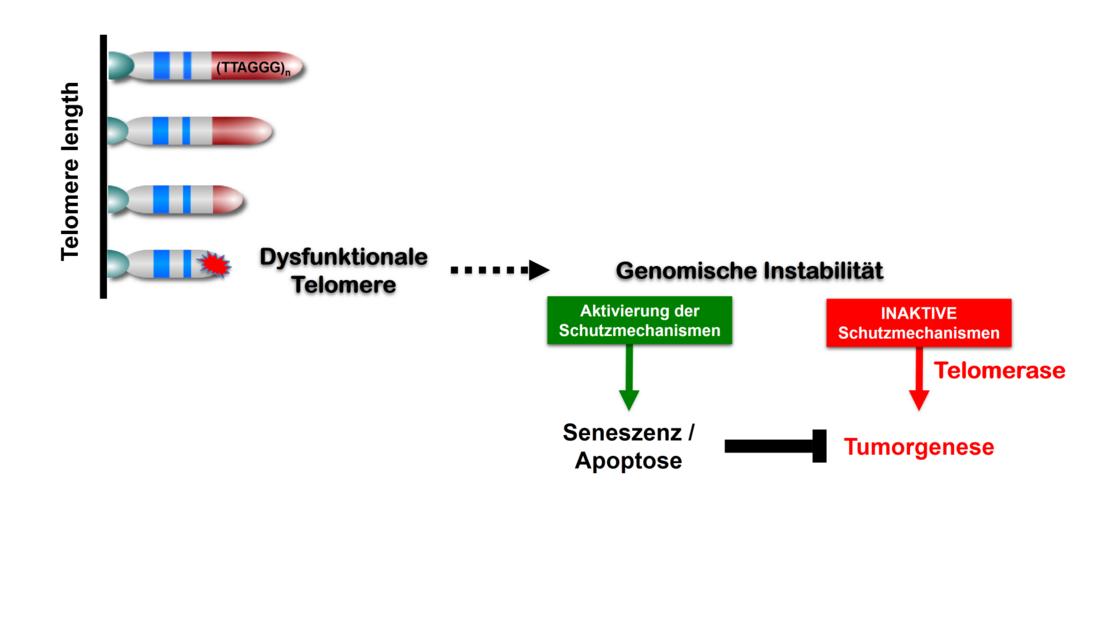
Die Telomere, spezielle Protein-DNA Komplexte an den Chromosomenenden haben eine Schlüsselfunktion beim Schutz des Erbguts, indem sie die Vermehrung von Zellen mit fehlerhafter Chromosomenanzahl unterdrücken und Tumorentstehung hemmen. Für die Replikation der Telomere wird ein spezielles Enzym, die Telomerase, benötigt. Interessanterweise wird beim Menschen die Aktivität der Telomerase während der frühen Embryonalentwicklung unterdrückt. Mit Ausnahme von adulten Stammzellen ist die Telomeraseaktivität in den meisten normalen Zellen unterdrückt. Dadurch verkürzen sich allerdings die Telomere. Eine biologische Erklärung dafür ist, dass auch Tumorzellen Telomerase benötigen und daher die Unterdrückung der Telomeraseaktivität während der frühen Embryonalentwicklung einen Schutzmechanismus gegen Tumorentstehung darstellt (Abb. 3).
Die Tumorzellen des Harnblasenkarzinoms sind nahezu alle Telomerase-positiv, wohingegen das urotheliale Normalgewebe Telomerase-negativ ist. Daher bietet die Hemmung der Telomeraseaktivität im Tumorgewebe einen möglichen Therapieansatz für Patienten mit diesen Tumoren. Das Verständnis über die molekularen Mechanismen der Telomerasereaktivierung im Harnblasenkarzinom und über die Rolle der Telomerase im Tumorgewebestellt einen weiteren Schwerpunkt der wissenschaftlichen Aktivitätendes urologischen Forschungslabors dar. Dieses genaue Verständnis ist essentiell für die Entwicklung von Telomerase-basierten Therapieansätzen.
Patienten abgeleitete Tumor Organoide als Methode der personalisierten Therapie bei Harnblasenkarzinom
Die Nutzung von Organoiden stellt eine neue Form der in vitro Kultivierung von Zellen dar. Hierbei werden Zellen in einem 3-dimensionalen Gerüst aus Proteinen kultiviert, die die in vivo Bedingungen des extrazellulären Bindegewebes nachempfinden sollen. Derartig kultivierte Zellen bilden unter den passenden Bedingungen kleinste Gewebe-Untereinheiten, die aus wenigen und teilweise unterschiedlich differenzierten Zellen bestehen, sogenannte Organoide. Die 3D Zellkultur bildet somit die in vivo Bedingungen im Körper besser nach als die gewöhnliche 2D Zellkultur.
Die neuen Techniken der 3D Zellkultur sollen es ermöglichen, Tumorzellen aus Patiententumoren zu kultivieren. Anschließend können diese Organoide im Vorfeld einer medikamentösen Therapie des Patienten für das Therapieansprechen in vitro bestimmt werden. Einerseits könnten dadurch die passenden Medikamente für den Patienten identifiziert werden, ohne Zeit mit einer potenziell ungeeigneten Erstlinientherapie zu verlieren. Andererseits würden dem Patienten auch mögliche Nebenwirkungen einer erfolglosen Therapie erspart bleiben.
Die Urologie des Uniklinikum Ulm bietet durch sowohl minimalinvasive als auch invasive offene Operationsverfahren beim Harnblasenkarzinom die Möglichkeit Patientenproben in großer Zahl zu akquirieren. Außerdem können Tumorproben von frühen und fortgeschrittenen Tumorstadien gewonnen werden. Dadurch wird fast das ganze Spektrum des Harnblasenkarzinoms abgedeckt. Bei zusätzlich erforderlicher adjuvanter Therapie nach der Operation können Vergleiche der Wirksamkeit in vivo und in vitro gestellt werden.
Publikationen
Wang X, Liu J, Azoitei A, Eiseler T, Meessen S, Jiang W, Zheng X, Makori AW, Eckstein M, Hartmann A, Stilgenbauer S, Elati M, Hohwieler M, Kleger A, John A, Zengerling F, Wezel F, Bolenz C, Günes C. Loss of ORP3 induces aneuploidy and promotes bladder cancer cell invasion through deregulated microtubule and actin dynamics. Cell Mol Life Sci. 2023 Sep 22;80(10):299.
Melzer MK, Schirge S, Gout J, Arnold F, Srinivasan D, Burtscher I, Allgöwer C, Mulaw M, Zengerling F, Günes C, Lickert H, Christoffels VM, Liebau S, Wagner M, Seufferlein T, Bolenz C, Moon AM, Perkhofer L, Kleger A. TBX3 is dynamically expressed in pancreatic organogenesis and fine-tunes regeneration. BMC Biol. 2023 Mar 20;21(1):55.
Muranyi, Andrew; Ammer, Tobias; Kechter, Anna; Rawat, Vijay PS; Sinha, Amit; Gonzalez-Menendez, Irene; Quintanilla-Martinez, Leticia; Azoitei, Anca; Günes, Cagatay; Mupo, Annalisa; ,Npm1 haploinsufficiency in collaboration with MEIS1 is sufficient to induce AML in mice,Blood Advances,7,3,351-364,2023.
Cramer, Paul; Yonemura, Yoji; Behrendt, Laura; Marszalek, Aleksandra; Sannai, Mara; Durso, William; Guenes, Cagatay; Szafranski, Karol; Nakamura, Nobuhiro; Nasrashvili, Tornike; ,A YIPF5-GOT1A/B complex directs a transcription independent function of ATF6 in ER export. bioRxiv, 2023.12. 12.569033,2023.
Wang W, Zheng X, Azoitei A, John A, Zengerling F, Wezel F, Bolenz C, Günes C. The Role of TKS5 in Chromosome Stability and Bladder Cancer Progression. Int J Mol Sci. 2022 Nov 18;23(22):14283. doi: 10.3390/ijms232214283. PMID: 36430759; PMCID: PMC9698602.
Melzer MK, Breunig M, Lopatta P, Hohwieler M, Merz S, Azoitei A, Günes C, Bolenz C, Kleger A. Protocol to use de-epithelialized porcine urinary bladder as a tissue scaffold for propagation of pancreatic cells. STAR Protoc. 2022 Dec 16;3(4):101869.
Melzer MK, Zehe V, Zengerling F, Wezel F, Günes C, Maisch P, Bolenz C. Organoide als Meilenstein auf dem Weg zur personalisierten Therapie des Urothelkarzinoms: ein systematischer Review [Organoids as a milestone on the way to personalized treatment of urothelial carcinoma: a systematic review]. Urologie. 2022 Jul;61(7):745-752. German. doi: 10.1007/s00120-022-01854-z. Epub 2022 Jun 13. PMID: 35925247.
Meessen S, Najjar G, Azoitei A, Iben S, Bolenz C, Günes C. A Comparative Assessment of Replication Stress Markers in the Context of Telomerase. Cancers (Basel). 2022 Apr 28;14(9):2205. doi: 10.3390/cancers14092205. PMID: 35565334; PMCID: PMC9103842.
Muranyi A, Ammer T, Kechter A, Rawat VPS, Sinha A, Gonzalez-Menendez I, Quintanilla-Martinez L, Azoitei A, Günes C, Mupo A, Vassiliou G, Bamezai S, Buske C. Npm1 haploinsufficiency in collaboration with MEIS1 is sufficient to induce AML in mice. Blood Adv. 2023 Feb 14;7(3):351-364. doi: 10.1182/bloodadvances.2022007015. PMID: 35468619; PMCID: PMC9898611.
Melzer MK, Breunig M, Arnold F, Wezel F, Azoitei A, Roger E, Krüger J, Merkle J, Schütte L, Resheq Y, Hänle M, Zehe V, Zengerling F, Azoitei N, Klein L, Penz F, Singh SK, Seufferlein T, Hohwieler M, Bolenz C, Günes C, Gout J, Kleger A. Organoids at the PUB: The Porcine Urinary Bladder Serves as a Pancreatic Niche for Advanced Cancer Modeling. Adv Healthc Mater. 2022 Jun;11(11):e2102345. doi: 10.1002/adhm.202102345. Epub 2022 Feb 18. PMID: 35114730.
Zheng X, Wezel F, Azoitei A, Meessen S, Wang W, Najjar G, Wang X, Kraus J, Kestler H, John A, Zengerling F, Bolenz C and Günes C. Shorter Leukocyte Telomere Length Is Associated with Worse Survival of Patients with Bladder Cancer and Renal Cell Carcinoma. Cancers. (Basel). 2021 July. Accepted
Walter K, Rodriguez-Aznar E, Ferreira MSV, Frappart PO, Dittrich T, Tiwary K, Meessen S, Lerma L, Daiss N, Schulte LA, Najafova Z, Arnold F, Usachov V, Azoitei N, Erkan M, Lechel A, Brümmendorf TH, Seufferlein T, Kleger A, Tabarés E, Günes C, Johnsen SA, Beier F, Sainz B Jr, Hermann PC. Telomerase and Pluripotency Factors Jointly Regulate Stemness in Pancreatic Cancer Stem Cells. Cancers (Basel). 2021 Jun 23;13(13):3145. doi: 10.3390/cancers13133145
Schneider L, Junnan L, Zhang C, Azoitei A, Meessen S, Zheng X, Cremer C, Gorzelanny C, Kempe-Gonzales S, Brunner C, Wezel F, Bolenz C, Gunes C*, John A. The Role of Interleukin-1-Receptor-Antagonist in Bladder Cancer Cell Migration and Invasion. Int J Mol Sci. 2021. Manuscript ID: ijms-1231167
Wezel F, Lustig J, Azoitei A, Liu J, Meessen S, Najjar G, Zehe V, Faustmann P, Zengerling F, John A, Martini T, Bolenz C, Günes C. Grainyhead-like 3 influences migration and invasion of urothelial carcinoma cells. Int J Mol Sci. 2021 Mar 15;22(6):2959.
Breunig et al. Modelling Plasticity and Dysplasia of Pancreatic Ductal Organoids Derived from Human Pluripotent Stem Cells. Manuscript Number: CELL-STEM-CELL-D-20-00326R3. Cell stem cell. 28, 1–20, 2021.
Diesinger T, Lautwein A, Bergler S, Buckert D, Renz C, Dvorsky R, Buko V, Kirko S, Schneider E, Kuchenbauer F, Kumar M, Günes C, Genze F, Büchele B, Simmet T, Haslbeck M, Masur K, Barth T, Müller-Enoch D, Wirth T, Haehner T. A New CYP2E1 Inhibitor, 12-Imidazolyl-1-dodecanol, Represents a Potential Treatment for Hepatocellular Carcinoma. Can J Gastroenterol Hepatol. 2021 Feb 2;2021:8854432.
John A, Günes C, Bolenz C, Vidal-Y-Sy S, Bauer AT, Schneider SW, Gorzelanny C. Bladder cancer-derived interleukin-1 converts the vascular endothelium into a pro-inflammatory and pro-coagulatory surface. BMC Cancer. 2020 Dec 2;20(1):1178.
Xu P, Richter J, Blatz A, Gärtner F, Alberts R, Azoitei A, Makori WA, Meessen S, Knippschild U, Günes C. Downregulation of ORP3 Correlates with Reduced Survival of Colon Cancer Patients with Advanced Nodal Metastasis and of Female Patients with Grade 3 Colon Cancer. Int J Mol Sci. 2020 Aug 16;21(16):5894
Stroth L, Tharehalli U, Günes C, Lechel A. Telomeres and Telomerase in the Development of Liver Cancer Cancers (Basel). 2020 Jul 24;12(8):2048.
Meessen et al., Establishment of Real-Time Multispectral Imaging for the Detection of Bladder Cancer Using a Preclinical in Vivo Model. Bladder Cancer, 2020. 285–294
Diesinger T, Buko V, Lautwein A, Dvorsky R, Belonovskaya E, Lukivskaya O, Naruta E, Kirko S, Andreev V, Buckert D, Bergler S, Renz C, Schneider E, Kuchenbauer F, Kumar M, Günes C, Büchele B, Simmet T, Müller-Enoch D, Wirth T, Haehner T. Drug targeting CYP2E1 for the treatment of early-stage alcoholic steatohepatitis. PLoS One. 2020 Jul 23;15(7). doi: 10.1371/journal.pone.0235990.
Lang A, Whongsiri P, Yilmaz M, Lautwein T, Petzsch P, Greife A, Günes C, Köhrer K, Niegisch G, Hoffmann M, Schulz WA. Knockdown of UTX/KDM6A Enriches Precursor Cell Populations in Urothelial Cell Cultures and Cell Lines. Cancers (Basel). 2020 Apr 21;12(4). doi: 10.3390/cancers12041023.
John A, Robador JR, Vidal-Y-Sy S, Houdek P, Wladykowski E, Günes C, Bolenz C, Schneider SW, Bauer AT, Gorzelanny C. Urothelial carcinoma of the bladder induces endothelial cell activation and hypercoagulation. Mol Cancer Res.2020 Mar 31. doi: 10.1158/1541-7786.MCR-19-1041.
Njeru SN, Kraus J, Meena JK, Lechel A, Katz SF, Kumar M, Knippschild U, Azoitei A, Wezel F, Bolenz C, Leithäuser F, Gollowitzer A, Omrani O, Hoischen C, Koeberle A, Kestler HA*, Günes C*, Rudolph KL*. Aneuploidy-inducing gene knockdowns overlap with cancer mutations and identify Orp3 as a B-cell lymphoma suppressor. Oncogene. 2020 Feb;39(7):1445-1465. doi: 10.1038/s41388-019-1073-2. * Corresponding authors.
Kriegmair MC, Rohter J, Grychtol B, Theuring M, Ritter M, Günes C, Michel MS, Deliolanis NC, Bolenz C. Multiparametric Cystoscopy for Detection of Bladder Cancer Using Real-time Multispectral Imaging. Eur Urol. 2020 Feb;77(2):251-259. doi: 10.1016/j.eururo.2019.08.024
S Meessen, S Iben, A Azoitei, S Wiese, C Bolenz, C Günes. Oncology Research and Treatment 2020. 43, 2-2
Morcos YAT, Najjar G, Meessen S, Witt B, Azoitei A, Kumar M, Wakileh G, Schwarz K, Schrezenmeier H, Zengerling F, Bolenz C, Günes C. A Novel Tissue and Stem Cell Specific TERF1 Splice Variant Is Downregulated in Tumour Cells. Int J Mol Sci. 2019 Dec 20;21(1). pii: E85. doi: 10.3390/ijms21010085.
Bolenz C, Rother J, Meessen S, Grychtol B, Majlesara A, Gharabaghi N, Günes C, Ritter M, Deliolanis N, Michel MS, Kriegmair MC. The development of real-time multispectral imaging for the diagnostics of bladder cancer. Urologe A. 2019 Sep 17. doi: 10.1007/s00120-019-01037-3.
Günes C, Meessen S, Rother J, Kriegmair MC, Zheng X, Hernandez D, Grychtol B, Deliolanis N, Bolenz C. Development of a rodent model for preclinical evaluation of multiple contrast agents and real-time multispectral imaging in bladder cancer European Urology Supplements 18 (1), e1955
Eckstein M, Wirtz RM, Pfannstil C, Wach S, Stoehr R, Breyer J, Erlmeier F, Günes C, Nitschke K, Weichert W, Otto W, Keck B, Eidt S, Burger M, Taubert H, Wullich B, Bolenz C, Hartmann A, Erben P. A multicenter round robin test of PD-L1 expression assessment in urothelial bladder cancer by immunohistochemistry and RT-qPCR with emphasis on prognosis prediction after radical cystectomy Oncotarget. 2018 Feb 19;9(19):15001-15014.
Günes C, Wezel F, Southgate J, Bolenz C. Implications of TERT promoter mutations and telomerase activity for urothelial carcinogenesis. Nat Rev Urol. 2018 Jun;15(6):386-393.
Meena J, Kraus J, Lechel A, Kumar M, Muehlberger M, Andrulis M, Moeller P, Wezel F, Bolenz C, Kestler HA, Rudolph K-L, Günes C. Expression Profile of Novel Ploidy-Control Genes in Bladder Cancer. Oncology Research and Treatment 41, 73-74
Bolenz, C., Knauf, D., John, A., Erben, P., Steidler, A., Schneider, S.W. Günes, C., Gorzelanny, C. Decreased Invasion of Urothelial Carcinoma of the Bladder by Inhibition of Matrix-Metalloproteinase 7. Bladder Cancer, vol. 4, no. 1, pp. 67-75, 2018
Günes, C. Avila, A.I., Rudolph, K.L. Telomeres in Cancer. Differentiation. 2017 Dec 21;99:41-50.
Kumar, M., Lechel, A., Günes C. Telomerase: The Devil Inside. Genes 7 (8), 2016 Jul 29;7(8).
Cindric Vranesic A., Reiche J., Hoischen C., Wohlmann A., Bratsch J., Friedrich K., Günes B., Cappallo-Obermann H., Kirchhoff C., Diekmann S., Günes C., Huber O. Characterization of SKAP/kinastrin isoforms: the N-terminus defines tissue specificity and Pontin binding. Hum Mol Genet. 2016 May 11.
Meena, J.K., Rudolph, K.L., Günes, C. Telomere Dysfunction, Chromosomal Instability and Cancer. Recent Results Cancer Res. 2015;200:61-79.
Meena, J.K., Cerutti, A., , Beichler, C., Morita, Y., Bruhn, C., Kumar, K., Kraus, J., Speicher, M.R., Wang, Z.-Q., Kestler, H.A., d'Adda di Fagagna, F., Günes, C.* and Rudolph, K.L.* Telomerase abrogates aneuploidy-induced telomere replication stress, senescence and cell depletion. EMBO J. 2015 May 12;34(10):1371-84.
* Corresponding authors.
Iben, S. and Günes, C. Telomerase exerts physiological and tumor promoting functions by stimulating ribosomal biogenesis. Telomerase and Telomeres. (2014) 1(1).
Gonzalez, O.G., Assfalg, R., Koch, S., Schelling, A., Meena, J.K., Kraus, J., Lechel, A., Katz, S-F., Benes, V., Scharffetter-Kochanek, K., Kestler, H.A., Günes, C.* and Iben, S*. Telomerase stimulates ribosomal DNA transcription in hyperproliferative conditions. Nature Communications. (2014) 5:4599.
* Corresponding authors.
Missios, P., Zhou, Y., Guachalla, LM., von Figura, G., Chakkarappan, SR., Binz, T., Gompf, A., Hartleben, G., Lellek, V., Günes, C., Sattler, RW., Song, Z., Illig, T., Klaus, S., Böhm, B., Wenz, T., Hiller, K. and Rudolph, KL. Glucose substitution prolongs lifespan of telomere dysfunctional mice by stimulating glycolysis and IGF-1 dependent mitochondrial biogenesis and oxidative glucose metabolism. Nature Communications. (2014) 5:4924.
Mesbah-Namin, S.A. and Gunes, C. Analysis of expression levels of E2F transcription factors in lineage negative hematopoietic stem cells of young and old mice. Molecular and Biochemical Diagnosis. (2014) 1:35-40, 2014.
Günes, C., Rudolph K.L. The role of telomeres in stem cells and cancer. Cell. (2013)152(3):390-3.
Kumar, M., Witt B., Knippschild, U., Koch, S., Meena, J.K., Heinlein, C., Weise, J.M., Krepulat, F., Kuchenbauer, F., Iben, S., Rudoplh, K.L., Deppert, W. and Günes, C. CEBP factors regulate TERT promoter activity in WAP-T mice during mammary carcinogenesis. Int J. Cancer. (2013)132(9):2032-43.
Günes C., Rudolph, K.L. Telomere dysfunction puts the brakes on oncogene-induced cancers. EMBO J. (2012) 31(13):2833-4.
Hirner, H., Günes, C., Wollf, S., Bischof, J., Grothey, A., Oswald, F., Giamas, G., Blatz, A., Wegwitz, F., Bösl, M., Henne-Bruns, D., Leithäuser, F., Deppert, W., and Uwe Knippschild. Impaired CK1 delta activity attenuates SV40-induced cellular transformation in vitro and mouse mammary carcinogenesis in vivo. PLoS One. (2012) 7(1).
Brassat, U., Balabanov, S., Bali, D., Dierlamm, J., Braig, M., Hartmann, U., Sirma, H.,Günes, C., Wege, H., Fehse., B., Gontarewicz, A., Dikomey, E., Borgmann, K., Brümmendorf, T-H. Functional p53 is required for effective telomerase inhibition in BCR-ABL-positive CML cells. Exp Hematol. (2011) 39(1):66-76.
Hartmann, D., Srivastava, U., Thaler, M., Kleinhans, K., Bauer, K., Kratzer, R.,Scheffold, A., Kloos, N., Katz, S.F., Song, Z., Begus-Nahrmann, Y., Kleger, A., von Figura, G., Lechel, A., Günes, C., N’Kontchou, G., Brecht, M., Potthoff, A., Deterding, K., Wedemeyer, H.H., Ju, Z., Song, G., Xiao, F., Gillen, S., Schrezenmeier, H., Mertens, T., Friess, T., Blöcker, H., Manns, M.P., Beaugrand, M., and Rudolph, K.L. Telomerase gene mutations are associated with cirrhosis formation. Hepatology. (2011) 53:1608-1617.
Sirma, H., Kumar, M., Meena, K.J., Witt B., Weise, J. M., Lechel, A., Ande, S., Sakk, V., Guillouzu, C., Zender, L., Rudolph, K.-L. and Günes, C. The Promoter of Human Telomerase Reverse Transcriptase is activated during Liver Regeneration and Hepatocyte Proliferation. Gastroenterology. (2011) 141(1):326-337.
Schriefer, P., Günes, C., Wege, H. Rapid Quantification of Telomerase Activity Employing an Improved Real-time Telomeric Repeat Amplification Protocol in Clinical Tissue Samples Eliminates Interference by PCR Inhibitors. Journal of Cancer Science & Therapy. (2011) 3(8):176-180.
Bagis, H., Aktoprakligil, D., Günes, C., Akkoc, T., Cetinkaya, G., Kankavi, O., Taskin, A-C, Arslan, K., Arat, S., Sekmen, S. Turgut, G., Tas, A., Dundar, M., Tsoncheva, V-L., Ivanov, I-G. Expression of Biologically Active Human Interferon Gamma Gene in the Milk of Transgenic Mice. Biochem Genet. (2011) 49(3-4):251-7.
Weise, J. M. and Günes, Ç. “Differential Regulation of Human and Mouse Telomerase Reverse Transcriptase Gene Promoter Activity during Testis Development”. Mol Reprod Dev. (2009) 76(3): 309-17.
Zafrakas, M., Tarlatzis, B., Streichert, T., Pournaropoulos, F., Wölfle, U., Wittek, B., Grimbizis, G., Papadimas, J., Pantel, K., Bontis, J. and Günes, Ç. Genome-wide microarray expression, absence of telomerase activity and array-CGH analysis in advanced ovarian endometriosis suggest high degree of differentiation rather than malignant potential. Int J Mol Med. (2008) 21(3):335-44.
Ritz, J.M., andGünes, Ç. Telomeres and Telomerase: A survey about methods and recent advances in cancer diagnostic and therapy. Histol Histopathol. (2006) 21: 1249-1261.
Ritz, J.M., Kühle, O., Riethdorf, S., Sipos, B., Deppert, W. Englert, C., and Günes, Ç. A Novel Transgenic Mouse Model Reveals Humanlike Regulation of an 8-kbp Human TERT Gene Promoter Fragment in Normal and Tumor Tissues. Cancer Res. (2005) 65(4), 1187-1196.
Zhang, B., Georgiev, O., Hagmann, M., Günes, Ç., Cramer, M., Faller, P., Vasak, M. and Schaffner, W. Activity of metal-responsive transcription factor 1 by toxic heavy metals and H2O2 in vitro is modulated by metallothionein. Mol Cell Biol. (2003) 23(23):8471-85.
Günes, Ç., Lichtsteiner, S., Vasserot, A. P. and Englert, C. Expression of the hTERT gene is regulated at the level of transcriptional initiation and repressed by Mad1. Cancer Res. (2000) 60, 2116-2121.
Auf der Maur A., Belser, T., Wang, Y., Günes, Ç., Lichtlen, P., Georgiev, O. and Schaffner, W. Characterization of the mouse gene for the heavy metal-responsive transcription factor MTF-1”. Cell Stress and Chaperones. (2000) 5 (3), 196-206.
Günes, Ç., Heuchel, R., Georgiev, O., Müller, K-H., Marino, S., Bluthmann, H., Aguzzi, A. and Schaffner, W.: “Embryonic lethality and liver degeneration in mice lacking the metal responsive transcriptional activator MTF-1. EMBO J. (1998) 17(10): 2846-2854.
Günes, Ç. and Müller-Hill, B.: Mutants in position 69 of Trp repressor of Escherichia coli K-12 with altered DNA-binding specificities. Mol. Gen. Genet. (1996) 251: 338-346.
Günes, Ç., Staacke, D., von Wilcken-Bergmann, B. and Müller-Hill, B.: Cooperative binding of two Trp repressor dimers to alpha or beta centered trp operators. Mol. Microbiol. (1996) 20(2) 375-384.
Günes, Ç., Staacke, D., von Wilcken-Bergmann, B. and Müller-Hill, B.: The possible roles of residues 79 and 80 of Trp repressor from Escherichia coli K-12 in trp operator recognition. Mol. Gen. Genet. (1995) 246: 180-195.
Kooperationen/Mitgliedschaften
- Bladder Cancer Research Initiative for Drug Targets Germany (BRIDGE) Consortium e.V.
- Deutscher Forschungsverbund Blasenkarzinom e.V. (DFBK e.V.)
- German Association for Aging Research (DGfA)
- Deutsche Hodentumor Studiengruppe (GTCSG)
- German Society of Residents in Urology (GeSRU) Academics
- UroEvidence
- Prof. Lotan, Dr. Krabbe, Department of Urology, UT Southwestern Medical Center, Dallas, Texas, USA
- Prof. Jennifer Southgate, Jack Birch Unit of Molecular Carcinogenesis, University of York, UK
- PD Dr. Wittenberg, T. Bergen Fraunhofer-Institut für Integrierte Schaltungen IIS, Erlangen
- Dr. Deliolanis, Fraunhofer IPA Projektgruppe für Automatisierung in der Medizin und Biotechnologie (PAMB), Mannheim
- Prof. Schneider, Dr. Gorzelanny, Sektion Experimentelle Dermatologie, Universitätsmedizin Mannheim, Fakultät für Medizin der Universität Heidelberg
- Prof. Michel, Prof. Ritter, Prof. Dr. Erben. Dr. Kriegmair, Klinik für Urologie, Universitätsmedizin Mannheim, Fakultät für Medizin der Universität Heidelberg
- Prof. Dr. Hans A. Kestler, Instituts für Medizinische Systembiologie, Ulm.
- Prof. Dr. Uwe Knippschild, Klinik für Allgemein- und Viszeralchirurgie, Ulm
- Prof. Dr. Karl-Lenhard Rudolph, Fritz-Lipmann-Institute für Alterungsforschung, Jena
- Prof. Dr. Wolfgang A. Schulz, Dr. Michele Hofmann, Klinik für Urologie, Düsseldorf
- Prof. Michael Höpfner, Institut für Physiologie, Charité Universitätsmedizin Berlin, Arbeitsgruppe molekulare Tumortherapie
- Prof. Dr. Alexander Kleger, Klinik für Innere Medizin (Gastroenterologie), Ulm
- Prof. Dr. Arndt Hartmann, Dr. Markus Eckstein, Pathologie, Universitätsklinik Erlangen
Patente
- Specific inhibitors of protein p21 as therapeutic agents
C Günes, EM Hoffman, KL Rudolph
US Patent App. 14/427,444
Sponsoren
- Deutsche Krebshilfe e.V.
- Deutsche Forschungsgemeinschaft
- Erich und Gertrud Roggenbuck-Stiftung
- Dieter Platt Förderpreis für Experimentelle Gerontologie
- Wilhelm Sander-Stiftung
- Else Kröner-Fresenius-Stiftung
AG Dr. Melzer
AG Dr. Melzer - Team

Dr. med. Michael Melzer
Assistenzarzt, Junior Group Leader, Clinician Scientist
Schwerpunkte
Pluripotente Stammzellmodelle, Urothelkarzinomorganoide, Organkulturmodelle

Dr. med. Yanchun Ma
Assistenzärztin, Clinical Scientist
Schwerpunkte
Urothelkarzinomorganoide, Assembloide

Simon Brüne
MD Student
Schwerpunkte
Urothelkarzinomorganoide, Assembloide

Clara Morgenstern
PhD Studentin
Schwerpunkte
Pluripotente Stammzellmodelle zur Urotheldifferenzierung