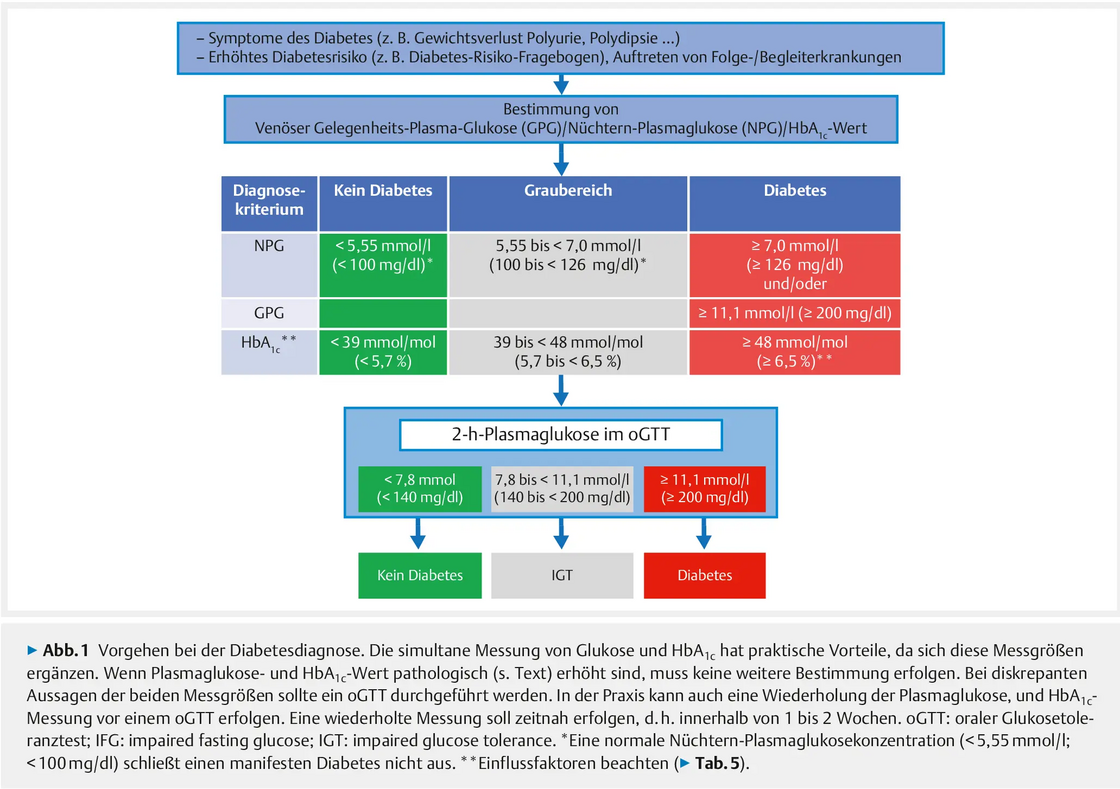
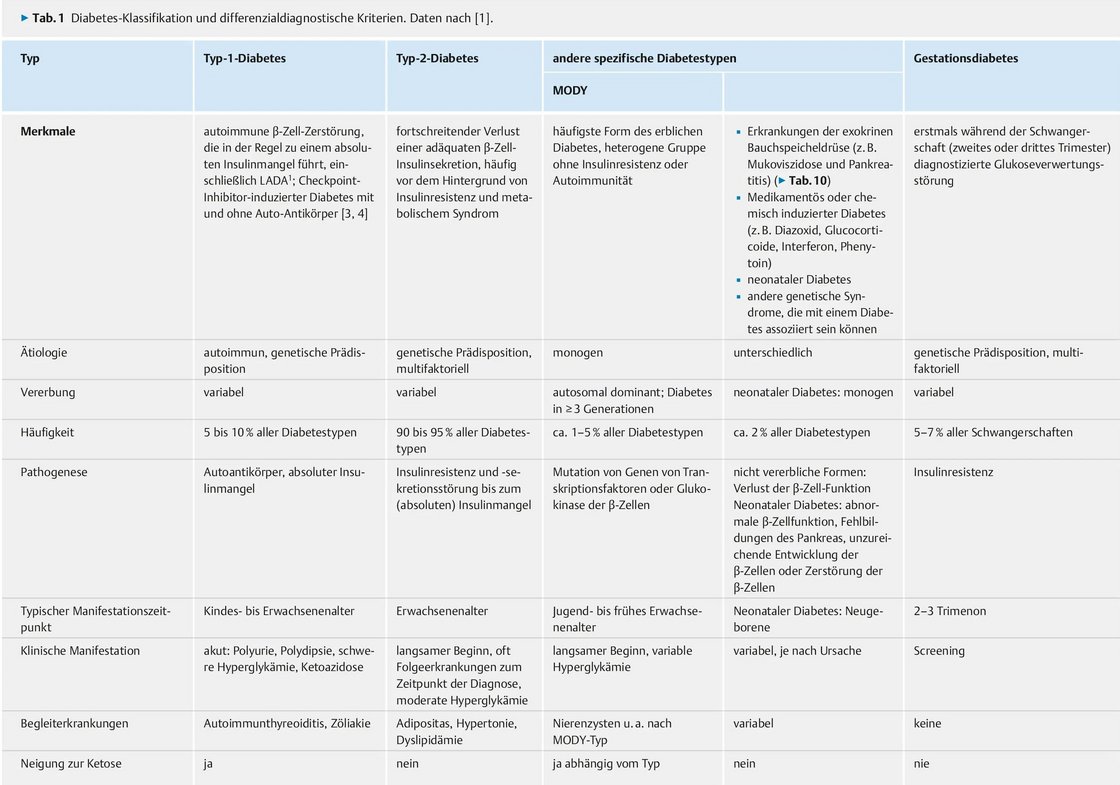
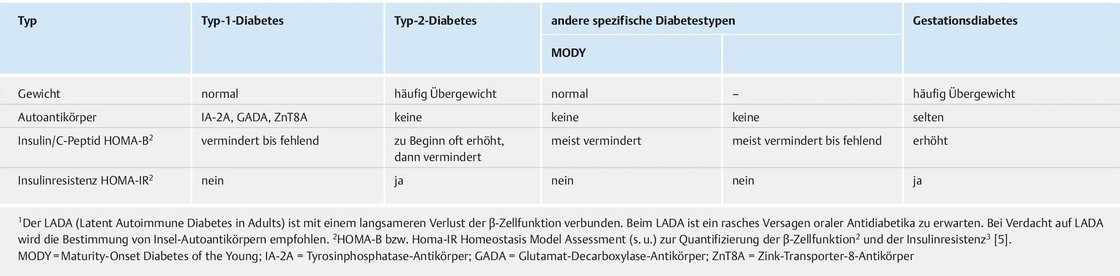
Durchführung des 75g oGTT - oraler Glukosetoleranztest - nach WHO-Richtlinien
Kategorie | Vorgaben / Empfehlungen |
Vorbereitung | - 8–12 h Nahrungskarenz |
Durchführung | 1. 75 g Glukose (oder äquivalente hydrolysierte Stärke) |
Kontraindikationen | - Zustand nach Magen-Darm-Resektion |
Glukoselösung | - Nur kommerziell hergestellte Fertigpräparate |
Variabilität | - Resorptionsverhalten intra- und interindividuell variabel |
Ein oGTT ist kontraindiziert bei zusätzlich bestehenden Erkrankungen, bei Z. n. Magen-Darm-Resektion, bei Z. n. bariatrischer Chirurgie oder gastrointestinalen Erkrankungen mit veränderter Resorption oder wenn bereits ein Diabetes mellitus festgestellt wurde. Bei der Durchführung des oGTT sollten ausschließlich kommerziell hergestellte Fertigarzneimittel mit einem Gesamtvolumen von maximal 300 ml verwendet werden.
Die Selbstherstellung der Glukoselösung für die Durchführung des oGTT wird von der DDG aus Gründen der Qualitätssicherung abgelehnt [5, 6]. Wie bei allen anderen Laboruntersuchungen ist Voraussetzung für die Diagnosestellung, dass der oGTT adäquat durchführt wird, inklusive Vorbereitung des Patienten. Das intra- und interindividuell variierende Resorptionsverhalten kann zu erhöhter Variabilität der Glukosekonzentrationen im oGTT führen [7].
letzte Änderung 05.02.2026
Bei Erreichen oder Überschreiten von mindestens einem der drei Grenzwerte im venösen Plasma wird ein Gestationsdiabetes mellitus diagnostiziert.
Grenzwerte im venösen Plasma nach IADPSG-Konsensus-Empfehlungen:
Zeitpunkt | mg/dl | mmol/l |
Nüchtern | ≥ 92 | ≥ 5,1 |
60 min | ≥ 180 | ≥ 10,0 |
120 min | ≥ 153 | ≥ 8,5 |
letzte Änderung 05.02.2026
1. Faktoren, die den HbA1c‑Wert senken
(v. a. durch erhöhten Erythrozyten‑Turnover)
Faktor | Mechanismus / Hinweis |
Hämolytische Anämie | verursacht z.B. durch immunologische Vorgänge oder bestimmte Medikamente (z.B. Cephalosporine) |
Behandlung von Eisen‑ oder Vitaminmangelanämie | Neubildung vieler junger Erythrozyten → niedrigerer HbA1c |
Schwere Leber‑ oder Niereninsuffizienz | Störungen im Erythrozytenstoffwechsel |
Hämatologische Erkrankungen (Thalassämien, abnorme Hämoglobine) | Erhöhter Turnover oder veränderte Hämoglobinstruktur |
2. Faktoren, die den HbA1c‑Wert erhöhen
(v. a. durch verminderten Erythrozyten‑Turnover)
Faktor | Mechanismus / Hinweis |
Anämien durch Eisen‑, B12‑ oder Folsäuremangel | Längere Lebensdauer der Erythrozyten → mehr Glykierung |
Splenektomie | Erythrozyten leben länger |
Alter | HbA1c steigt physiologisch um ca. 0,4–0,7 % (4–8 mmol/mol) |
Ethnizität | Afroamerikaner im Mittel ~0,4 % (4 mmol/mol) höher als Kaukasier |
3. Störfaktoren, die die Messung verfälschen können
Störfaktor | Mechanismus / Hinweis |
Hämoglobinvarianten | Je nach Messmethode falsch hohe oder niedrige Werte |
Fortgeschrittene Nephropathie | HbA1c unzuverlässig, v. a. bei renaler Anämie oder EPO‑Therapie |
4. Situationen, in denen HbA1c nicht zur Diabetes‑Diagnose geeignet ist
Situation | Grund |
Neugeborene (HbF ~ 90 %) | HbA1c nicht aussagekräftig |
Schwangere | Physiologische Veränderungen, veränderte Erythrozytenlebensdauer |
Frauen bis 2 Monate post partum | Postpartale Veränderungen |
Einnahme hyperglykämischer Medikamente (Glukokortikoide, Psychopharmaka < 2 Monate) | HbA1c spiegelt kurzfristige Hyperglykämie nicht korrekt wider |
Erkrankungen des Pankreas inkl. OP | Störungen der Insulinsekretion, unzuverlässige HbA1c‑Interpretation |
Bluttransfusionen, Blutspende, große Blutverluste | Gemischte oder erneuerte Erythrozyten verfälschen den Wert |
5. Empfehlung
Empfehlung | Hintergrund |
Aktuelles Blutbild vor HbA1c‑basierter Diagnostik | Erkennen von Anämien oder Störfaktoren |
6. Altersabhängigkeit des HbA1c
Alterseffekt | Beschreibung |
Anstieg um 0,4–0,7 % (4–8 mmol/mol) | Physiologischer Anstieg bei Menschen ohne Diabetes |
Altersgruppe | Roth J et al., 2016 (n = 6783) | Masuch A et al., 2019 (n = 8665) |
< 40 Jahre | 27–41 mmol/mol (4,6–5,9 %) | 20–42 mmol/mol (4,0–6,0 %) |
40 bis < 60 Jahre | 29–44 mmol/mol (4,8–6,2 %) | 21–44 mmol/mol (4,1–6,2 %) |
≥ 60 Jahre | 31–46 mmol/mol (5,0–6,4 %) | 25–49 mmol/mol (4,4–6,6 %) |
letzte Änderung 05.02.2026
Form | Typische Hinweise / Red Flags | Diagnostische Konsequenz |
Pankreopriver Diabetes (z. B. nach Pankreatitis) | Vorgeschichte Pankreasentzündung oder OP; exokrine Mitbeteiligung möglich | C‑Peptid zur Restsekretion; ggf. Bildgebung; Therapie wie Typ 3c |
Monogener Diabetes (MODY, neonatal) | Manifestation < 25–35 J.; erhaltenes C‑Peptid; Autoantikörper negativ (GAD, IA‑2, ZnT8); autosomal-dominante Familienanamnese; milde stabile Nüchterhyperglykämie (GCK‑MODY); extrapanreatische Zeichen (z. B. Nierenzysten bei HNF1B) | Genetische Testung (MODY‑Panel); Therapieanpassung (z. B. Sulfonylharnstoff bei HNF1A‑MODY) |
Steroidinduzierter Diabetes / Endokrine Ursachen (Cushing, Akrom) | Klinische Konstellation (Langzeitsteroide, endokrine Symptome) | Hormon‑Work‑up; ggf. Bildgebung; Therapie der Grunderkrankung |
Algorithmus bei unklarer Typzuordnung
Schritt | Ziel |
1. Inselautoantikörper | Nachweis Autoimmunität → Typ 1 |
2. C‑Peptid (nüchtern / standardisiert) | Abschätzung endogener Insulinsekretion (Typ 1 vs. Typ 2 vs. pankreoprive Form) |
3. MODY‑Panel bei Red Flags | Bestätigung monogener Form → gezielte Therapie |
Haftungsausschluss
Jegliche Informationen wurden und werden vor ihrer Veröffentlichung mit äußerster Sorgfalt überprüft. Es wird jedoch keinerlei Gewähr für die Aktualität, Korrektheit, sachliche Richtigkeit, Vollständigkeit oder Qualität der bereitgestellten Informationen übernommen. Haftungsansprüche welche sich auf Schäden materieller oder ideeller Art beziehen, die durch die Nutzung oder Nichtnutzung der dargebotenen Informationen bzw. durch die Nutzung fehlerhafter und unvollständiger Informationen verursacht wurden, sind grundsätzlich ausgeschlossen, sofern nachweislich kein vorsätzliches oder grob fahrlässiges Verschulden vorliegt. Die Verwendung und Nutzung der Zusammenstellungen liegt daher alleine im Verantwortungsbereich des Nutzers/der Nutzerin, welche/r das Universitätsklinikum Ulm AöR gegenüber Ansprüchen Dritter schad- und klaglos halten wird (Haftungsfreistellung). Alle Veröffentlichungen sind freibleibend und unverbindlich. Es wird ausdrücklich vorbehalten, Teile der Veröffentlichung oder die gesamte Veröffentlichung ohne gesonderte Ankündigung zu verändern, zu ergänzen, zu löschen oder die Veröffentlichung zeitweise oder endgültig einzustellen.