Probengewinnung
Probennahme
Folgende Störfaktoren und Einflussgrössen werden bei der Entnahme von Venenblut am häufigsten missachtet und beeinflussen oder stören die Bestimmungen:
- Stauung (Freisetzen von Gewebsthromboplastinen, Hämolyse, Zelluntergang, Hämokonzentration, Ischämie)
- "Pumpen" und "Klopfen" (Freisetzen von Gewebsthromboplastinen, Hämolyse, Zelluntergang)
- Entnahme aus einem liegenden Katheter oder proximal davon (Kontamination).
- Die Reihenfolge der Blutentnahme (Freisetzen von Gewebsthrombplastinen, Hämolyse, Zelluntergang, "Gewebsstanze").
- Traumatische Blutentnahme "Stochern" (Freisetzen von Gewebsthromboplastinen, Zelluntergang).
- Zeitpunkt der Medikamentengabe bei Medikamentenbestimmungen (Tal-/Spitzen-/Throughkonzentrationen).
- Tageszeit (möglichst morgens zwischen 7-9 Uhr, circadiane Rhythmik).
- Position (liegend, Hämokonzentration im Stehen/Sitzen).
- Körperliche Aktivität (Patient sollte seit mindestens 10 Minuten liegen, keine starke körperliche Anstrengung während der letzten 3 Tage, Muskeluntergang).
- Vorhergegangener Alkoholexzess (Muskeluntergang).
- Raumtemperatur (Zentralisation).
- Ernährung (in der Regel nüchtern).
- Forciertes Ziehen bei der Blutentnahme (Hämolyse).
- Lagerung der Proben: die Proben sollten sofort in das Labor verbracht werden. Leukozyten verbrauchen auch im Probengefäß Glukose und produzieren Laktat sowie IL-8; die lagerungsbedingte Lyse der roten und weißen Blutkörperchen erhöht LDH, GPT, Kalium und erniedrigt die Zellzahl; die Gerinnungsfaktoren nehmen ab.
Das Stauen sollte kürzer als 30 Sekunden sein. Sobald die Vene punktiert ist, sollte die Stauung gelöst werden.
Störfaktoren und Einflußgrössen welche dem Labor mitgeteilt werden sollten:
Bitte teilen Sie dem Labor folgende Information zu den Proben mit:
- Geburtsdatum; die Referenzbereiche im Befundausdruck sind teilweise altersabhängig. Bei Frühgeborenen gilt das Gestationsalter. Für ältere Patienten (>120 Jahre) gibt es teilweise keine Referenzbereiche.
- Geschlecht, die Referenzbereiche im Befundausdruck orientieren sich teilweise am biologischen Geschlecht.
- Bei auf die Körperoberfläche bezogenen Bestimmungen Grösse und Gewicht (z.B. Clearancebestimmungen).
- Bei Bestimmungen aus Sammelurin den Sammelzeitraum und das Gesamtvolumen (Clearancebestimmungen und Ausscheidungen.
- Bei Medikamentenkonzentrationsbestimmungen den Abnahmezeitpunkt in Relation zu Gabe (vor oder nach Gabe). Besonders wichtig für Ciclosporin und Heparin Faktor-X-Aktivität.
- Bei Fragen der Toxizität von Medikamentenkonzentrationen, wie für Methotrexat, Salicylate und Paracetamol, sollte der genaue Zeitpunkt seit der Einnahme/Applikation bekannt sein.
- Die vorherige Gabe von Antikörpern, sei es zu therapeutischen oder diagnostischen Zwecken. Bei einer Gabe von Mausantikörpern zu therapeutischen oder diagnostischen Zwecken kann der Patient Antikörper gegen Maus-IgG entwickeln, welche immunologische Assays auf der Basis von Mausantikörpern stören.
- Das Vorliegen solcher HAMA (Humane Anti-Maus-Antikörper) sollte ebenfalls mitgeteilt werden.
- Für die Bestimmung der Blutgase die Körpertemperatur des Patienten, da die Sauerstoffbindungskurve temperaturabhängig ist und somit die Sättigung des Hämoglobins durch die Körpertemperatur beeinflusst wird.
Die Blutentnahme sollte atraumatisch erfolgen: ohne Klopfen, Ballen der Faust oder Stochern im Gewebe. Die Kanüle sollte nicht zu klein (>12er Gr/>22 G), zu kleine Kanülen verzögern den Blutfluß) und scharf sein.
Die Blutentnahme sollte möglichst bei einem seit mindestens 10 Minuten liegenden Patienten erfolgen:
Im Klinikum Ulm sind keine Vakuumgefässe im Umlauf, der Aspirationsunterdruck sollte nur leicht appliziert werden, kein übermäßiges Ziehen.
Hinweis für Benutzer welche Vakuumprobenentnahmegefäße vorziehen:
Es ist möglich in den Monovetten vor der Blutabnahme ein Vakuum anzulegen, hierfür wird der Stempel bis zum Anschlag heruntergezogen, dieser rastet im Maximalfüllstellung ein.
Wird aus einem Verweilkatheter/Kanüle entnommen sind mindestens 10 ml Blut zu verwerfen. Siehe hierzu auch den Pflegestandard PortPunk.
Blut zur Medikamentenbestimmungen kann grundsätzlich nicht aus dem Katheter entnommen werden wenn über diesen das Medikament appliziert wurde.
Heparin, Fettlösungen, ölige Medikamentenösungen (Immunsuppressiva), hochprozentige Glukose- oder Nährlösungen sowie Röntgenkontrastmittel sind nicht aus Kathetern entfernbar, daher sind solchermassen kontaminierte Venenzugänge nicht für Blutentnahmen zu verwenden.
Blutproben sollten nicht an einem Arm abgenommen werden, an dem ein Infusion läuft.
Beispiel: Patient mit einem Hb von 8,3 g/l erhält zwei Erykonzentrate. Die Kontrollabnahme zeigt einen unbefriedigenden Hb-Anstieg auf 8,9 g/l.
Erklärung: Die Kontrollprobe wurde an einem Arm mit laufender Elektrolyt-Infusion abgenommen und durch die laufende Infusion verdünnt. Eine weitere Abnahme am anderen Arm erbrachte dann einen Hb von 10,1 g/l. Wäre dem Patient aufgrund des mangelndes Hb-Anstiegs, durch weitere, eigentlich unberechtigter, Transfusion z.B. mit Hepatitis-C infiziert worden, könnten die Konsequenzen schwerwiegend sein.
Unbedingt vor der Blutentnahme die Übereinstimmung der Patientenidentität mit den Etiketten auf den Abnahmegefäßen überprüfen!
Die Reihenfolge der Blutentnahme ist zu beachten. Hierzu gibt es eine Empfehlung des National Commmittee for Clinical Laboratory Standards (NCCLS, siehe unten, Literatur)
Die Abnahmeröhrchen sind farbkodiert. International nach ISO 6710 bzw. europäisch nach EN 14820. Die am Klinikum verwendeten Röhrchen sind europäisch kodiert:
Nach der Entnahme sollte das Blut durch Überkopfwenden mindestens 3-5 mal gemischt werden und möglichst sofort in das Labor transportiert werden. Bitte beachten Sie für den Transport/Versand die gültigen Hygienerichtlinien des Klinikums.
Eine Zwischenlagerung des unzentrifugierten Blutes im Kühlschrank oder auf der Station ist nicht zulässig. Das Bereichslabor Eselsberg ist rund um die Uhr besetzt, eine Annahme ist immer möglich!
Citratplasma:
Vor der Abnahme von Citratplasma sollte immer die Abnahme eines anderen Röhrchen erfolgen, auch wenn dieses verworfen werden muss. Wenn z.B. Li-Heparin-Plasma, EDTA und Citratplasma abgenommen wird, erfolgt die Abnahme des Li-Heparin-Plasma/EDTA-Plasma vor dem Citratplasma. Wird nur Citratplasma abgenommen muss ein "Leerröhrchen" verworfen werden.
Serum:
Bei Serumproben muss die Probe vor der Weiterverarbeitung durchgeronnen sein. Dieses braucht ca. 30-60 Minuten. Bei Patienten mit therapeutischer Heparinisierung gerinnt das Blut auch innerhalb dieser Zeitspanne nicht. Um die Zeitspanne für die Verarbeitung so kurz wie möglich zu halten, haben wir für den Großteil der Proben Li-Heparin-Plasma als Untersuchungsmaterial gewählt. Das in diesen Monovetten benutzte Heparin verdrängt Bindungsproteine, deshalb werden Proben zur Bestimmung von Hormone und besonders deren freien Anteile, aus Serumproben bestimmt.
Liquor:
Für die Bestimmung der Zellzahl und Zellen im Liquor sollte die erste Portion nach Punktion verworfen, oder allenfalls für biochemische Untersuchungen verwendet werden. Durch die Punktion kommt es zum Ablösen von Haut- und anderen Zellen, schlimmstenfalls als "Stanzzylinder", welche durch die Kanüle in die Probe ausgeschwemmt werden.

Hinweis zur Entfernung der Stempel:
Auf jeden Fall sollte nach der Blutabnahme, unabhängig vom Füllungsstand der Monovette, der Stempel bis zum Anschlag heruntergezogen werden und entfernt (abgedreht, nicht gebrochen) werden.
Nicht vollständig entfernte Stempel bei halbgefüllter Monovette werden durch die Zentrifugation heruntergepresst und bilden dann ein Hindernis bei der weiteren Verarbeitung, was bis zum Geräte defekt führen kann:

Die oben abgebildeten Monovetten führte zu diesem Ergebnis!

Bei Urinmonovetten kann der Monovetteninhalt nach Zentrifugation unter den Stempel geraten und entzieht sich damit der Analyse.
Die erforderliche Füllmenge von Probengefäßen variiert je nach Anzahl der angeforderten Untersuchungen und lässt sich daher nicht pauschal angeben. Grundsätzlich sollte für jede Bestimmungsgruppe (EDTA, Citrat, Serum, Plasma) mindestens ein vollständig gefülltes Abnahmegefäß bereitgestellt werden.
Bei beleglosen Anforderungen berechnet das Laborinformationssystem automatisch den ungefähren Bedarf an Blut und erzeugt die entsprechende Anzahl an Probenetiketten.
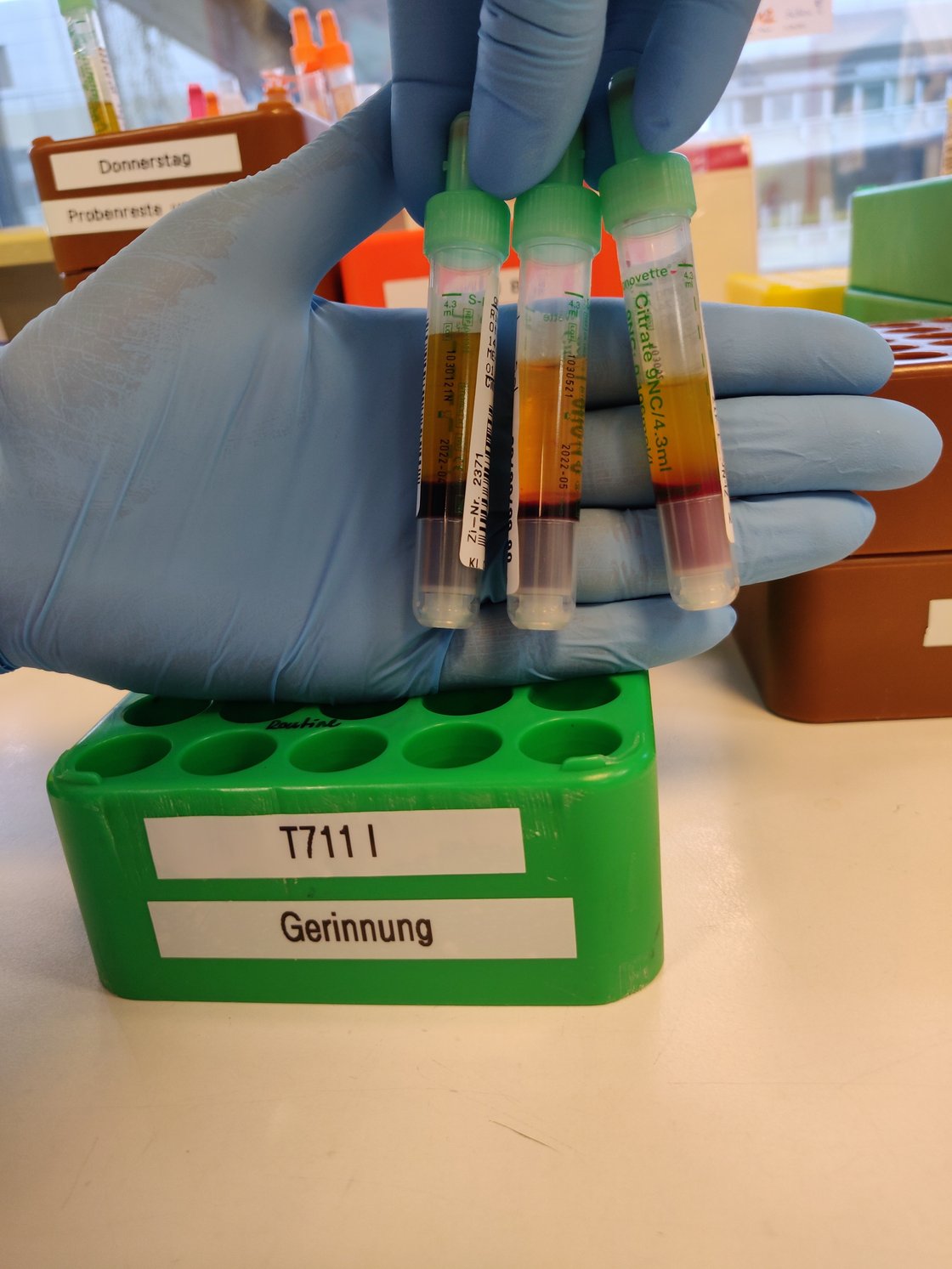
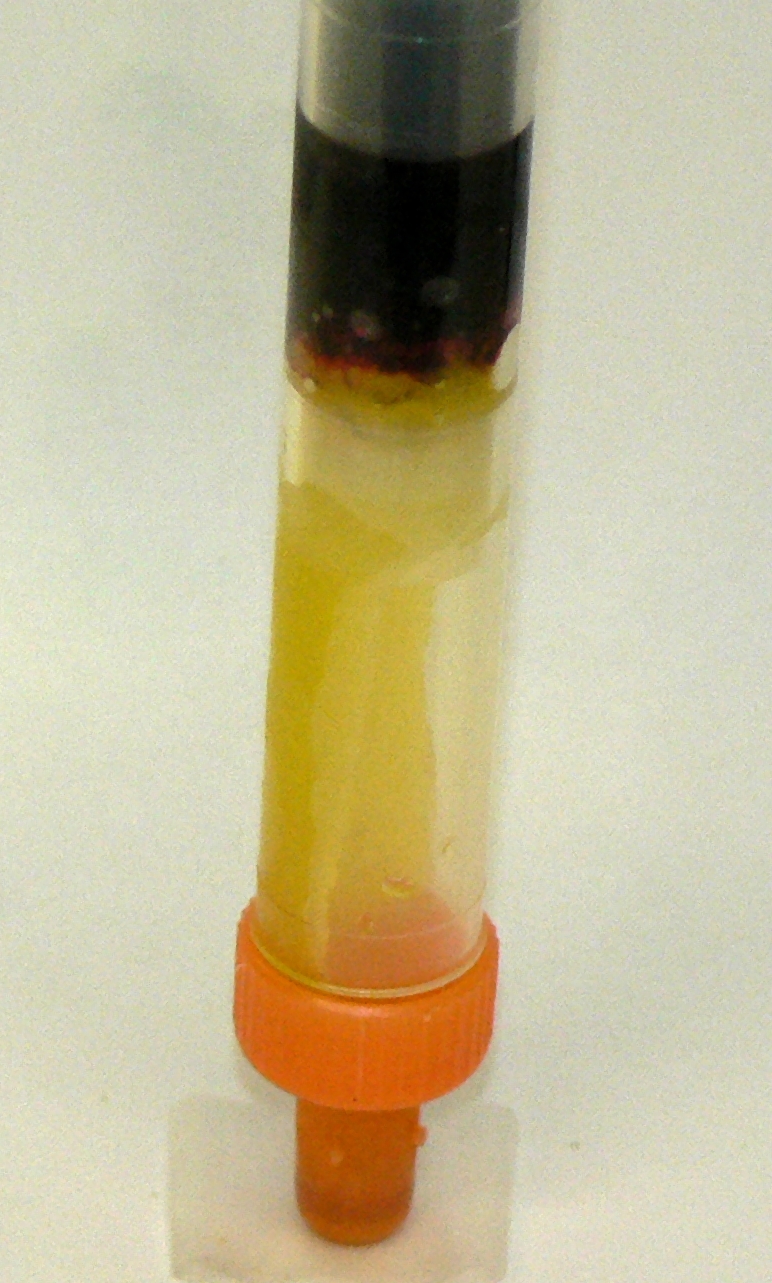
Kritisch ist die Befüllung der Gerinnungs-/Citrat-Gefäße:
Bei Citratgefäßen muss das Verhältnis von Blut zu Citrat exakt stimmen. Schon geringe Über- oder Unterfüllungen verfälschen die Gerinnungswerte – besonders bei bereits gestörter Gerinnung.
Laut CLSI H21-A5 sind maximal 10 % Unterfüllung zulässig (bei 4,3 ml Citratblut etwa 430 µl).
Diskussionen über den Füllstand oder Berechnungen der Messwerte anhand der Füllmenge sind daher nicht sinnvoll. Entscheidend ist eine korrekte Befüllung des Röhrchens.
Beispiele für eine nicht ausreichende Befüllung:
Nach der Probenentnahme:
Besonders bei Kinderproben wird gelegentlich eine abgenommene Probe auf verschiedene Probengefäße verteilt. Wird z.B. eine Serumprobe nachträglich auf eine EDTA oder Citratprobe verteilt kann die Probe schon angeronnen sein und die Bestimmungen verfälschen Der Gerinnungsprozess ist zwar erst mit dem Gelieren der Probe abgeschlossen, beginnt aber sofort bei der Punktion des Gefäßes und besonders im Kontakt mit Fremdoberflächen, wie Kunstoffgefäßen. Selbst wenn das Blut nicht sichtbar geliert ist läuft somit schon der Prozess der Gerinnung ab. Die Gerinnungsuntersuchungen aus aufgefüllten Citratgefäßen sind somit verfälscht, ebenso sind die Thrombozyten in umgefüllten EDTA-Gefäßen erniedrigt.
Wird umgekehrt eine EDTA oder Citratprobe in ein Plasma- oder Serum umgefüllt sind ebenfalls vielfältige Interferenzen zu erwarten. Und wenn eine EDTA-Probe in ein Citratgefäß umgefüllt wird können keine Gerinnungsuntersuchungen durchgeführt werden, da die Probe ungerinnbar bleibt.
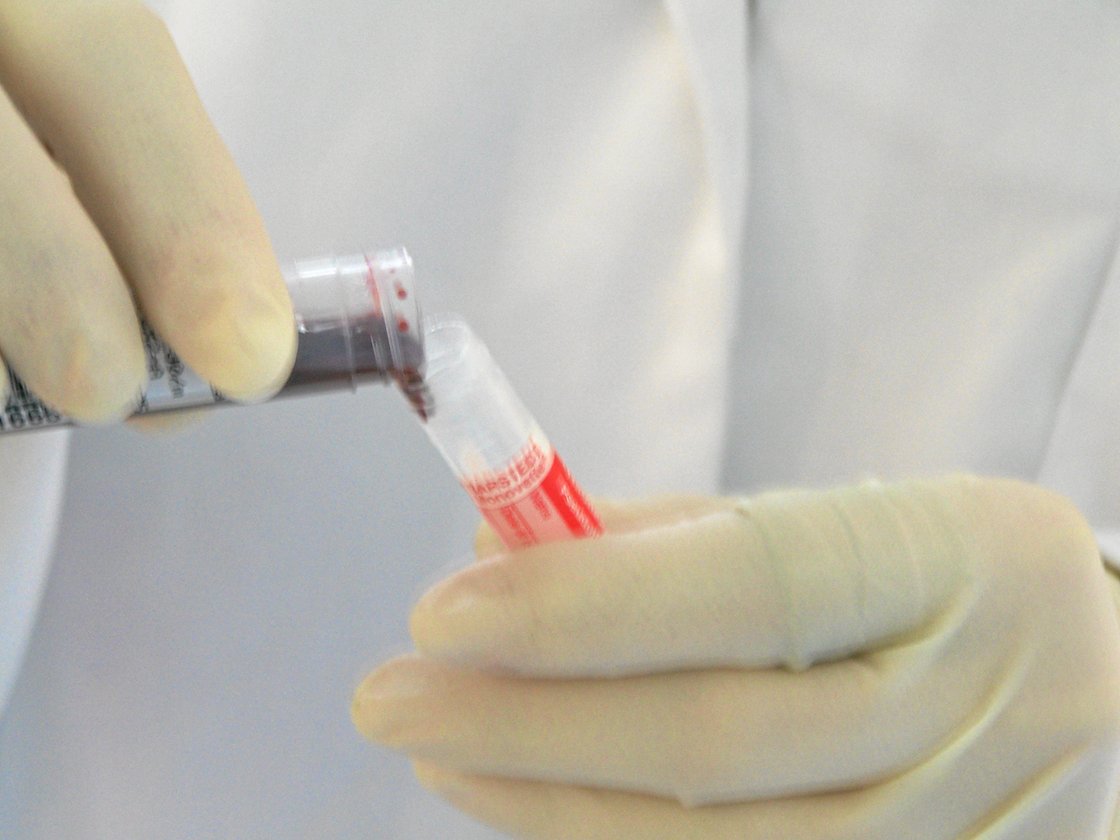
Richtig kompliziert wird es, wenn wenn während der Umfüllaktion auch noch die Deckel vertauscht werden und die EDTA-Probe mit dem Deckel einer Lithium-Heparin-Probe aus einer Serumprobe umgeschüttet wurde. Alles schon da gewesen:
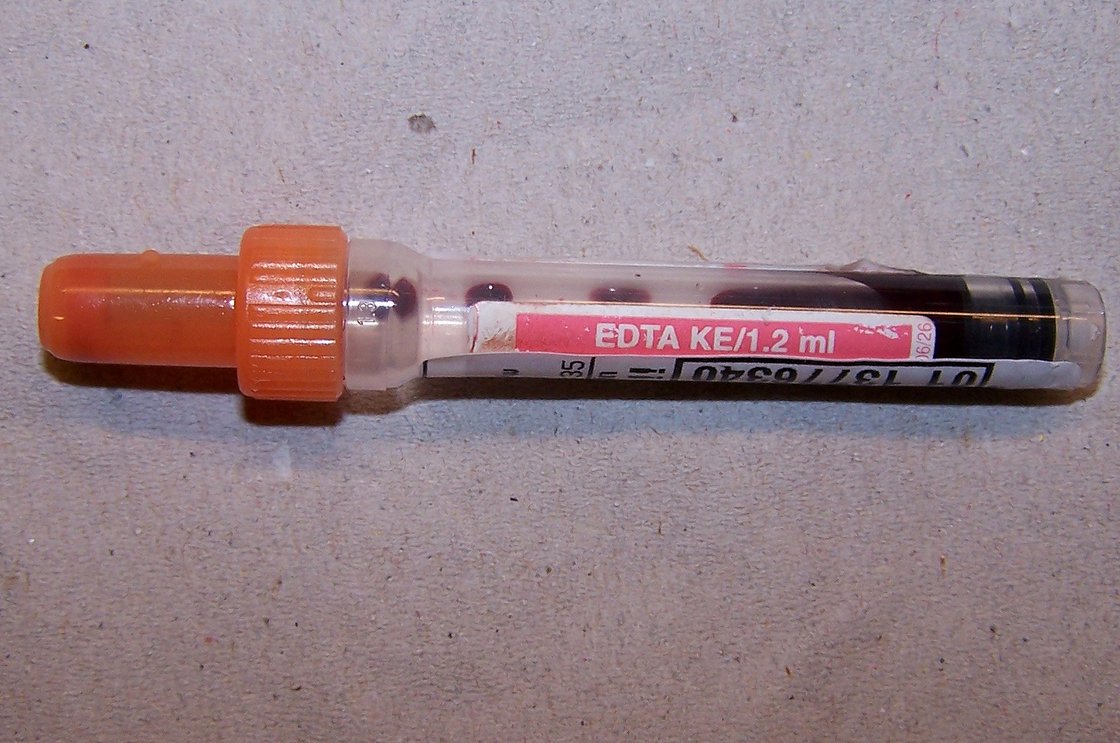
Proben können im Kühlschrank aufbewahrt werden, aber nur wenn Blutkuchen und Plasma von einander getrennt ist! Proben sollten deshalb nicht über das Wochenende im Kühlschrank aufbewahrt werden. Ebenfalls grundfalsch ist das Einfrieren von Vollblut. Die Zellen werden dadurch zerstört und setzten ihren Inhalt frei, die Probe ist hämolytisch. Zellzählungen sind dann sowieso unmöglich, Enzyme und Substrate falsch erhöht. Leider tritt bei einmaligen Einfrieren und Auftauen nicht ein Totalhämolyse auf, so dass der Probe vor Zentrifugation nicht auf dem ersten Blick die eingetretene Hämolyse anzusehen ist. Da die Ursache der Hämolyse auch auf Grund eines pathologischen Zustandes auftreten kann, wird die Probe im Labor meist trotzdem untersucht und nur der vom Labor vergebene Hinweis "Probe hämolytisch" weist auf die fehlerhafte Lagerung hin.
Literatur:
NCCLS – Guidelines, Collection, Transport and Processing of Blood Specimens for Coagulation Testing and General Performance of Coagulation Assays; Approved Guideline – Fifth Edition, H21-A5; Vol 28 No 5;January 2008
NCCLS - Procedures for the Collection of Diagnostic Blood Specimens by Venipuncture; Approved Standard—Fifth Edition
H3-A5 Vol. 23 No. 32, December 2003
NCCLS – Urinanalysis; Approved Guideline – Third Edition, GP16-A3 Vol. 29 No 4 2009.
Witt I, Beeser H, Müller-Berghaus G. Minimalanforderungen zur Gewinnung von Citratplasma für hämostaseologische Analysen. Lab Med 1995; 19: 143-5
letzte Änderung 09.01.2024