Nierenkrebs (Nierenzellkarzinom)
Ansprechpartner
Spezialsprechstunde Onkologie:
Anmeldung zur Spezialsprechstunde unter Infos für Ärzte
Therapie und Forschung in der Klinik für Innere Medizin III
Die Behandlung des metastasierten Nierenzellkarzinoms hat sich in den letzten 10 Jahren grundlegend verändert. Während bis 2005 die Systemtherapie auf die Immunmodulation durch die Zytokine Interferon-alfa und Interleukin-2 beschränkt war, haben in den letzten Jahren molekular-zielgerichtete Strategien wie Tyrosinkinase-Inhibitoren, mTOR-Hemmer und monoklonale Antikörper einen wichtigen Stellenwert in der Behandlung des metastasierten inoperablen Nierenzellkarzinoms eingenommen. Auch die Immuntherapie konnte entscheidende Fortschritte erzielen. Die sogenannten Check-Point-Inhibitoren zeigten in klinischen Studien nicht nur eine deutliche Wirksamkeit, sondern auch, dass das Tumorwachstum in einigen Fällen langfristig eindämmbar ist. Dabei ist es gegenwärtig in Ermangelung klinisch einsetzbarer prädiktiver Marker nicht möglich, diejenigen Patienten zu selektionieren, die bevorzugt von einer dieser Therapien profitieren. Die Leitlinien der meisten Fachgesellschaften sehen einen risikostratifizierten Therapieansatz vor, in dem Patienten durch den MSKCC-Score in Risikogruppen eingeteilt werden. Die daraus resultierende Therapieempfehlung beschränkt sich in der Erstlinientherapie in allen Risikogruppen auf die neuen Substanzen. In der Mehrzahl der Fälle werden im Krankheitsverlauf mehrere Substanzen mit unterschiedlichen Wirkprofilen als Sequenztherapie zum Einsatz kommen. Die optimale Sequenz wird gegenwärtig noch in klinischen Studien untersucht.
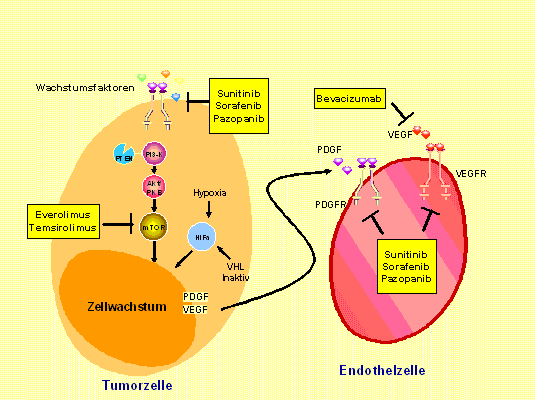
Durch ein inaktiviertes VHL-Protein kommt es bei klarzelligen Nierenzellkarzinomen zu vermindertem Abbau des Transkriptionsfaktors HIF-alfa. Hierdurch werden vermehrt Substanzen wie VEGF und PDGF gebildet die für das Gefäßwachstum innerhalb des Tumors unerlässlich sind. Ein alternativer Aktivierungsmodus der Tumorzelle ist der Weg über PI3-K, AKT-PKB und mTOR. Die Wege sind miteinander verbunden, da mTOR die Translation von HIF-alfa reguliert. Es sind die Wirkorte aller im Text erwähnten Substanzen in der Tumorzelle und der Endothelzelle angezeigt.
Am Universitätsklinikum Ulm werden alle Stadien und Formen des Nierenzellkarzinoms behandelt. Ein Schwerpunkt der Klinik für Innere Medizin III liegt in der Behandlung des fortgeschrittenen Nierenzellkarzioms und hierbei in der Durchführung von kontrollierten klinischen Studien. Ziel dieser klinischen Studien ist die Verbesserung der derzeitigen Standardtherapien, sowie die Erforschung individueller Risikofaktoren.
Klinische Studien
Weitere Informationen zu den aktiven Studien erhalten Sie unter:
Beschreibung der Erkrankung
Das Nierenzellkarzinom ist eine bösartige Erkrankung der Niere.
Häufigkeit und Erkrankungsalter, Lokalisation
Bösartige Nierentumoren machen ca. 3% aller bösartigen Neubildungen beim Erwachsenen aus. In Deutschland gibt es pro Jahr etwa 5700 Frauen und 8300 Männer, die neu an Nierenkrebs erkranken. Das durchschnittliche Erkrankungsalter liegt bei Männern bei 63 Jahren und für Frauen bei 67 Jahren. Männer erkranken etwa 1,5mal häufiger als Frauen.
Bösartige Tumore in der Niere bezeichnet man nach dem Gewebe, aus welchem der Tumor entstanden ist. Etwa 90% aller Nierentumoren sind Nierenzellkarzinome. Bei den übrigen 10% handelt es sich um Sarkome, Nephroblastome (Wilms-Tumor), Embryonalkarzinome oder Neuroblastome.
Die eher seltenen Nierenbeckenkarzinome entstehen aus der Schleimhaut des Harntraktes und sind deshalb keine Nierenkarzinome, sondern sie gehören zu den Blasen-, bzw. Harnleiterkarzinomen und werden entsprechend anders behandelt.
Meistens ist nur eine Niere von der Tumorerkrankung betroffen. Bei nur ca. 1,5% sind beide Nieren befallen.
Krankheitszeichen
Nierenkarzinome verursachen im Frühstadium selten Beschwerden und werden deshalb häufig zufällig z.B. bei einer Ultraschalluntersuchung entdeckt. Schmerzen in der Flanke, im Rücken, Blut im Urin (rötliche bis braune Verfärbung) können Hinweis auf eine Nierenerkrankung sein, aber auch Koliken, Gewichtsverlust, Blutarmut, Fieber, hoher oder niedriger Blutdruck, Darmbeschwerden oder ständige Abgeschlagenheit. Oft stecken hinter diesen Beschwerden aber harmlose Ursachen.
Die Früherkennung bietet bei bösartigen Tumorerkrankungen die größte Chance auf Heilung.
Klassifikation und Stadieneinteilung
Um die am besten geeignete Therapie bestimmen zu können, muss vor Therapiebeginn durch die oben genannte Diagnostik genau festgestellt werden, wie weit sich der Tumor ausgebreitet hat, das heißt das Tumorstadium wird ermittelt. Hierfür verwendet man unter anderem die TNM-Klassifikation (siehe Tabelle unten).
T steht für die Größe und Ausdehnung des Primärtumors, N steht für die Anzahl der befallenen regionären Lymphknoten und M steht für das Auftreten und die Lokalisation von Fernmetastasen (Tumorabsiedlungen).
TNM für Nierenzellkarzinome nach UICC 2002
TX Primärtumor kann nicht beurteilt werden NX Benachbarte (regionäre) Lymphknoten sind nicht beurteilbar Mx Vorliegen von Fernmetastasen kann nicht beurteilt werden |
Eine abschliessende Beurteilung des TNM-Stadiums ist erst nach der Tumoroperation möglich.
Zwei weitere Kriterien sind für die weitere Therapie entscheidend. Die mikroskopische Untersuchung des Tumorgewebes gibt Hinweise auf die Bösartigkeit des Tumors. Hierbei wird die Ähnlichkeit der Krebszellen mit den Organzellen verglichen (siehe Tabelle unten).
Zellähnlichkeit = Grading nach UICC 2002
GX Präparat feingeweblich nicht beurteilbar |
Zum anderen ist es von entscheidender Bedeutung, ob der Tumor vollständig entfernt werden konnte (siehe Tabelle unten).
R = Residualtumor (Resttumor nach OP)
RX Residualtumor kann nicht bestimmt werden |
Therapeutische Möglichkeiten
Die Therapiemethoden sind vom Tumorstadium abhängig. Je früher ein Nierenzellkarzinom erkannt wird, umso günstiger ist die Prognose für den Patienten. Aber auch das Alter und der allgemeine Gesundheitszustand des Patienten werden bei der Therapieauswahl berücksichtigt.
Kurative (heilende) Operation
Nierenentfernung (Nephrektomie) mit Lymphknotenentfernung
Die Standardtherapie ist die komplette Entfernung der tumorbefallenen Niere. Damit ist eine Chance auf Heilung beim Nierenzellkarzinom gegeben. Die Aufgabe der entfernten Niere wird dann von der verbliebenen gesunden Niere übernommen.
Bei manchen Patienten ist es möglich die Nierenentfernung durch eine Laparoskopie (Schlüssellochtechnik) durchzuführen.
Nierenteilentfernung
Die Teilentfernung bei kleineren Tumoren ist mittlerweile ein akzeptiertes Verfahren und verspricht ein gleiches Überleben wie die komplette Entfernung der Niere.
Tumorresektion
Bei ca. 30% aller Nierenzellkarzinompatienten liegt bereits zum Zeitpunkt der Diagnosestellung eine Lymphknoten- oder Fernmetastasierung vor. Das wird als palliative Situation bezeichnet. Es gibt Hinweise darauf, dass eine Tumorentfernung in palliativer Situation einen Überlebensvorteil bringen kann, wenn im Anschluß eine systemische Therapie durchgeführt wird. Bei Patienten mit nicht wesentlich erhöhtem Operationsrisiko kann deshalb eine Tumorentfernung auch im metastasierten Stadium angeboten werden.
Systemtherapie
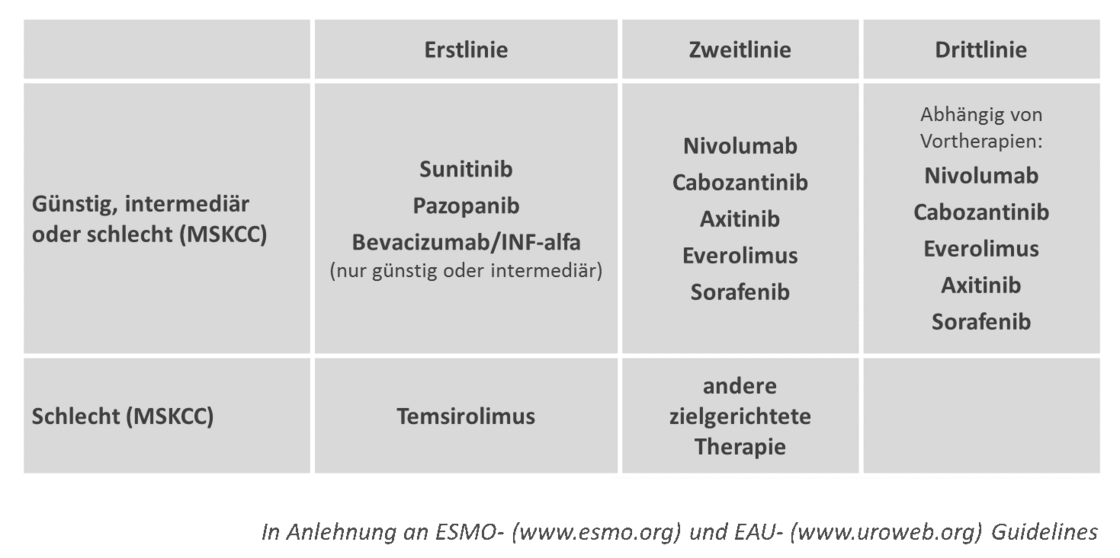
Zielgerichtete molekulare Therapien sind der Therapiestandard in der Erst- und Zweitlinienbehandlung des metastasierten klarzelligen Nierenzellkarzinoms; die Zytokintherapie spielt lediglich noch eine untergeordnete Rolle. Gegenwärtig existieren keine klinisch nutzbaren prädiktiven Biomarker, die das Ansprechen auf eine dieser Therapien voraussagen können. Daher empfehlen die Fachgesellschaften ein risikostratifiziertes Vorgehen auf dem Boden des MSKCC-Risiko-Scores. In Abhängigkeit von Erst- und Zweitlinien-Status, sowie des Risikoprofils sind im Juli 2016 in Deutschland die Substanzen Sunitinib, Pazopanib, Axitinib, Sorafenib, Everolimus, Temsirolimus, Bevacizumab plus Interferon-alfa und Nivolumab in der Behandlung etabliert. Die Zulassung von Cabozantinib in Deutschland steht ebenfalls unmittelbar bevor. Erstmals wird auch die Zulassung einer Kombinationstherapie der zielgerichteten Substanzen erwartet: die Kombination des Tyrosinkinaseinhibitors Lenvatinib mit dem mTOR-Inhibitor Everolimus. Durch die Kombination dieser beiden Substanzen kann zwar eine Verlängerung der Remissionsdauer erreicht werden, erkauft wird dies allerdings durch eine deutlich höhrere Rate an Nebenwirkungen. Welchen Stellenwert diese Kombinationstherapie in der Therapielandschaft des Nierenzellkarzinoms einnehmen wird, ist daher noch Gegenstand der wissenschaftlichen Diskussion.
Die optimale Sequenz der Substanzen wäre nur durch ein Forschungsprogramm zu ermitteln, das die biologische Rationale für die jeweilige Sequenz erklärt. In Anbetracht des höheren Lebensalters vieler Patienten mit Nierenzellkarzinomen empfiehlt es sich, durch eine Beachtung der Komorbiditäten und unmittelbare präemptive Therapie der Nebenwirkungen, die Compliance des Patienten zu sichern und so in der gegebenen palliativen Therapiesituation den maximalen therapeutischen Nutzen bei einer guten Lebensqualität zu erreichen.