Das Institut bearbeitet bakterielle Proteintoxine
Wir untersuchen das Zusammenspiel von Proteinen in funktionellen Komplexen, die den Transport von Proteinen und Peptiden über Zellmembranen vermitteln. Als ideale Modelle hoch spezialisierter und extrem effizienter Proteintransportmaschinen dienen Bakterientoxine, die im Inneren menschlicher Zellen wirken.
Diese modular aufgebauten Proteine besitzen verschiedene funktionelle Untereinheiten für Rezeptorbindung (B) und Membrantransport (T), worüber sie ihre enzymatisch aktive Untereinheit (A) in das Zytosol menschlicher Zellen transportieren. Dort modifiziert die A Untereinheit ihr spezifisches Substrat, was zur Zellschädigung und den klinischen Symptomen der Toxin-vermittelten schweren Erkrankungen wie Diptherie, Keuchhusten (Pertussis), Mizbrand (Anthrax), Tetanus oder Botuslismus führt.
Aufgrund dieser besonderen Struktur und Wirkungsweise stellen bakterielle Proteintoxine die giftigsten bekannten Substanzen dar.
Unsere grundlegenden Forschungsarbeiten zur Wirkungsweise bakterieller Toxine finden konkrete pharmakologische Anwendung in den nachfolgend dargestellten Bereichen zur Suche pharmakologischer Toxin-Inhibitoren und zur Entwicklung molekularer Transporter für den gezielten Wirkstofftransport in Immun- und Krebszellen.
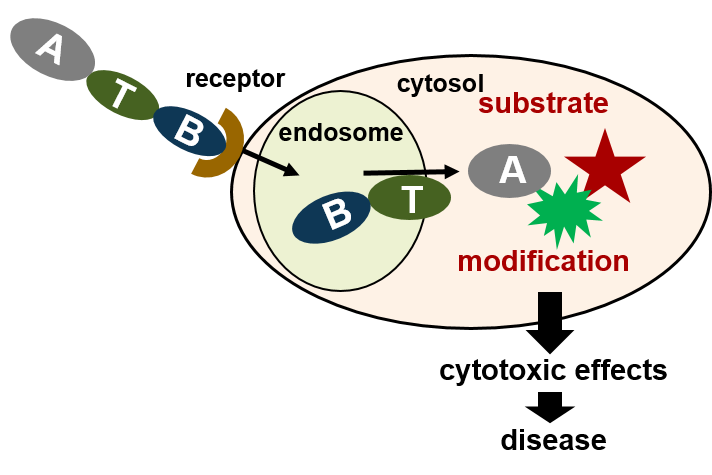
Charakterisierung der molekularen und zellulären Wirkung sowie der zellulären Aufnahme bakterieller Proteintoxine
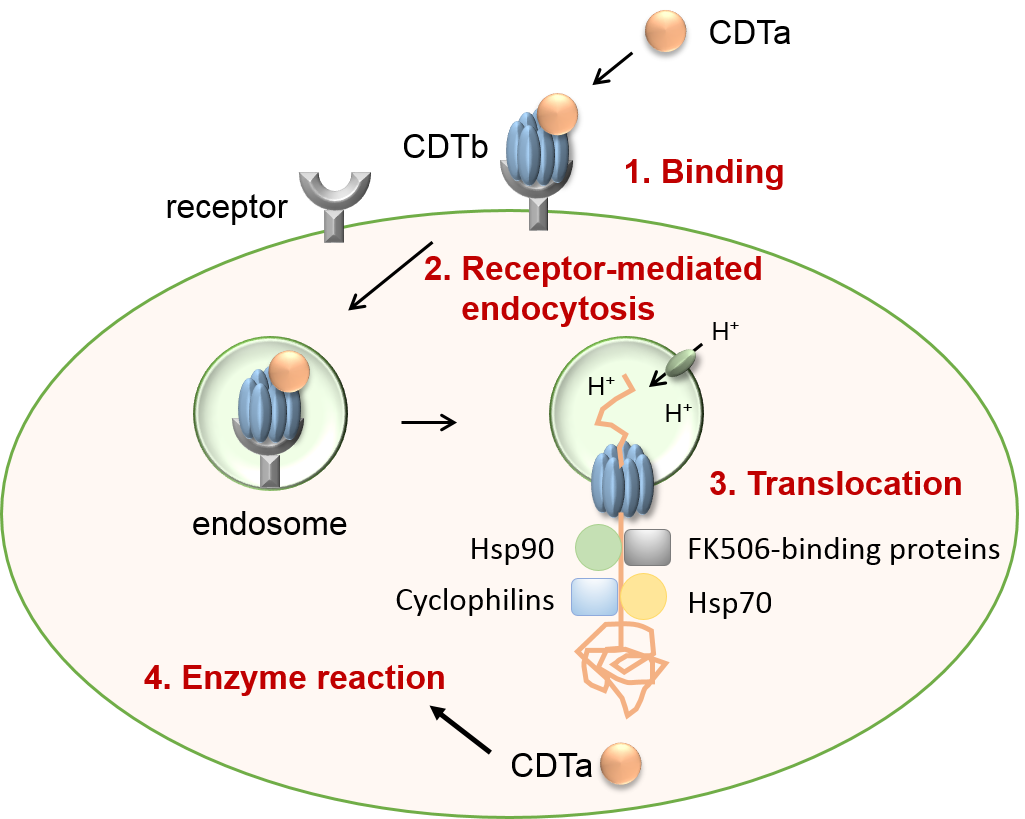
Wir konnten für verschiedene medizinisch relevante Toxine wie Diphtherietoxin, Pertussistoxin, Anthraxtoxin oder die clostridialen Enterotoxine zeigen, dass bestimmte Untereinheiten in Endosomen Transmembranporen bilden, die den Transport entfalteter Enzymuntereinheiten über Endosomenmembranen vermitteln. Dabei binden spezifische Motive der translozierenden Proteine direkt an zelluläre Chaperone (Hsp90, Hsp70) und Peptidyl-prolyl cis/trans Isomerasen, so dass funktionelle Proteintransportmaschinen entstehen, die den Membrantransport vermitteln. Von besonderem Interesse sind für uns die Mechanismen, die in Zellen zur zeitlich und räumlich koordinierten Aggregation solch funktioneller Multiproteinkomplexe führen, ihre Strukturen und ihre Rolle bei der Entfaltung und Rückfaltung translozierender Proteine.

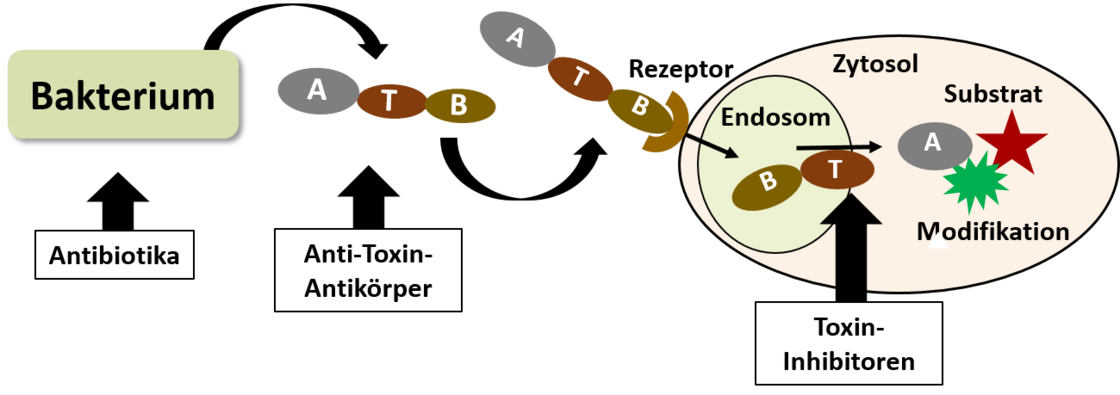
Identifizierung und Charakterisierung pharmakologischer Inhibitoren zur gezielten Neutralisierung bakterieller Toxine
Bakterielle Proteintoxine sind die giftigsten bekannten Substanzen und direkte Auslöser zahlreicher lebensbedrohlicher Erkrankungen beim Menschen, weshalb sie wichtige Wirkstoff-Ziele darstellen und die Entwicklung pharmakologischer Toxin-Inhibitoren von hoher wissenschaftlicher und medizinischer Relevanz ist. Gelingt es, die Aufnahme der enzymatisch aktiven A-Untereinheit der Toxine in das Zytosol der Zielzelle zu hemmen, so bleibt die Substratmodifikation und damit die Zellschädigung aus, welche die Grundlage der klinischen Symptome darstellt.
Dies ist insbesondere von Bedeutung, da die vorhandenen antibakteriellen Wirkstoffe („Antibiotika“) nur gegen Bakterien, aber nicht gegen die bereits von den Bakterien freigesetzten Toxine, wirksam sind. Weiterhin können Toxin-Inhibitoren attraktive pharmakologische Optionen gegen (multi)resistente Toxin-bildende Erreger wie Clostridioides difficile darstellen. In diesem Projektbereich verfolgen wir folgende Ansätze:
- Suche nach Toxin-Inhibitoren im humanen Peptidom; z.B. Defensine (im SFB 1279)
- Entwicklung maßgeschneiderte Synthese von Toxin-Inhibitoren, die gezielt strukturelle Anteile der Toxine inaktivieren; z.B. synthetische Toxinporen-Blocker (Dendrimere etc.)
- Neuartige Anwendung von etablierten, für andere Anwendungen zugelassenen, Medikamenten als Toxin-Inhibitoren; z.B. Bacitracin, Cyclosporin A (CsA), FK605 (Tacrolimus), Chloroquin, Cyclodextrine

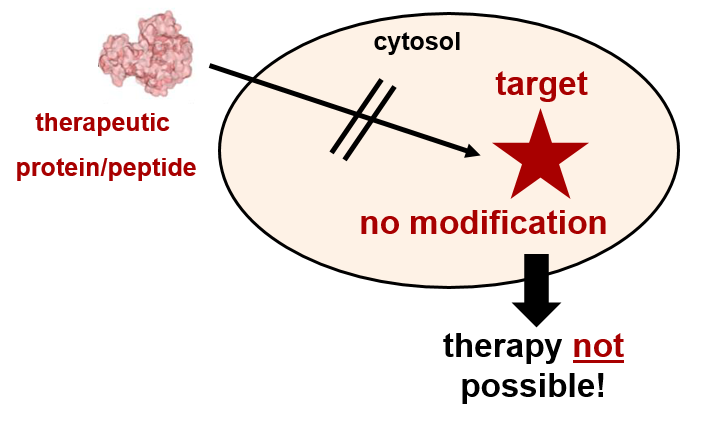
Entwicklung molekularer Nanomaschinen für den gezielten Transport pharmakologisch wirksamer (Makro)moleküle in das Innere menschlicher Zellen: Gezielte Modulation zellulärer Funktionen bei Trauma, Krebs und Infektionskrankheiten
Viele biologische Wirkstoffe wie Proteine, Enzyme, Peptide oder Nukleinsäuren („biologics“), zeigen eine sehr gute und spezifische Wirksamkeit gegen ihre jeweiligen Zielmoleküle, sind aber therapeutisch nicht anwendbar, weil ihre Wirkstoffziele („drug tragets“) im Zyotosol bestimmter Zellen oder im Zentralnervensystem liegen und daher von diesen Makromolekülen nicht erreicht werden können, weil diese nicht über Zellmembranen gelangen. Daher ist die Entwicklung molekularer Transportsysteme zum gezielten und effektiven Einschleusen solcher Wirkstoffe in das Zellinnere und ihrer kontrollierten Freisetzung im Zytosol von großer Bedeutung und Gegenstand unserer Forschungsarbeit.
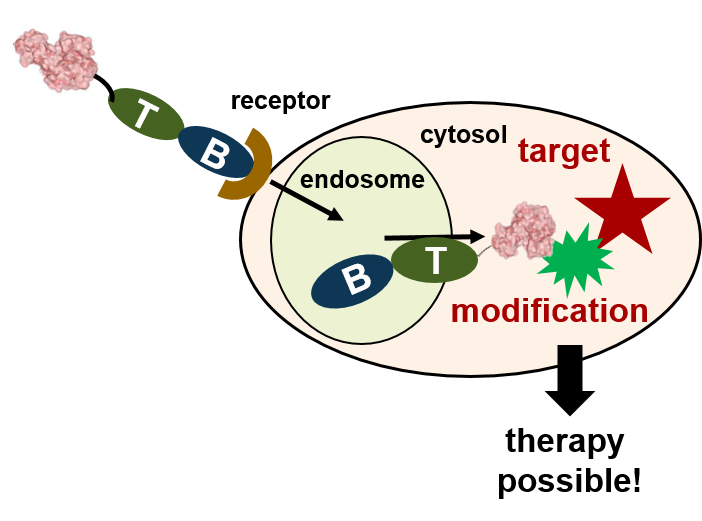
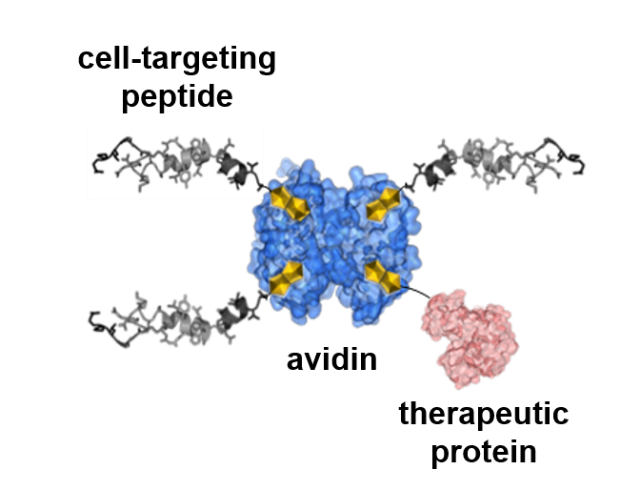
Unsere Ergebnisse zum zellulären Proteintransport finden direkte pharmakologische Anwendung in der Entwicklung neuartiger modularer „Nanomaschinen“ für den Zelltyp-selektiven Transport und die kontrollierte Freisetzung therapeutischer (Makro)moleküle (z.B. Proteine, Peptide) in das Zytosol menschlicher Zellen. Dabei werden die jeweils optimalen Proteinuntereinheiten für Rezeptorerkennung, Membrantransport und Enzymaktivität zu neuen hybriden Molekülen zusammengesetzt, wobei rekombinante Proteintransporter sowie semi-synthetische Molekülkomplexe durch Biotin/Avidin-Technologie generiert werden.
Die Transporter werden in interdisziplinären und translationalen Projekten, u.a. in den Ulmer SFBs 1149 und 1279, um pathophysiologische Mechanismen von Trauma, Infektions- und Tumorerkrankungen zu untersuchen und neuartige pharmakologische Ansätze gegen solche Erkrankungen zu entwickeln.
Aktuelle Drittmittelprojekte
Molekulare, biochemische und funktionelle Analyse von Shiga Toxin und Subtilase Untereinheiten enterohämorrhagischer Escherichia coli (H. Barth/ H. Schmidt)
Hemmung bakterieller Proteintoxine, insbesondere der Toxine von Clostridioides difficile, durch Faktoren und Spaltprodukte des menschlichen Komplementsystems (H. Barth/M. Huber-Lang)
Multifunctional peptide nanocarriers for regulating cell migration in the microenvironment of metastatic breast cancer cells (T. Weil/H. Barth; C01 im SFB 1279)
Biohybridtransporter zum zellspezifischen Transport und der kontrollierten Freisetzung von pharmakologisch aktiven Peptiden (H. Barth/J. Michaelis; C02 im SFB1279)
Zelluläre und molekulare Effekte der Trauma-induzierten Schädigung des distalen respiratorischen Epithels (H. Barth/M. Frick; A05 im SFB1149)
Endogenous peptides as novel inhibitors of the Bordetella pertussis toxin (H. Barth; A06 im SFB 1279)